نانو تکنولوژی در پزشکی: درمانهای هوشمند
مقدمهای بر نانو تکنولوژی در پزشکی
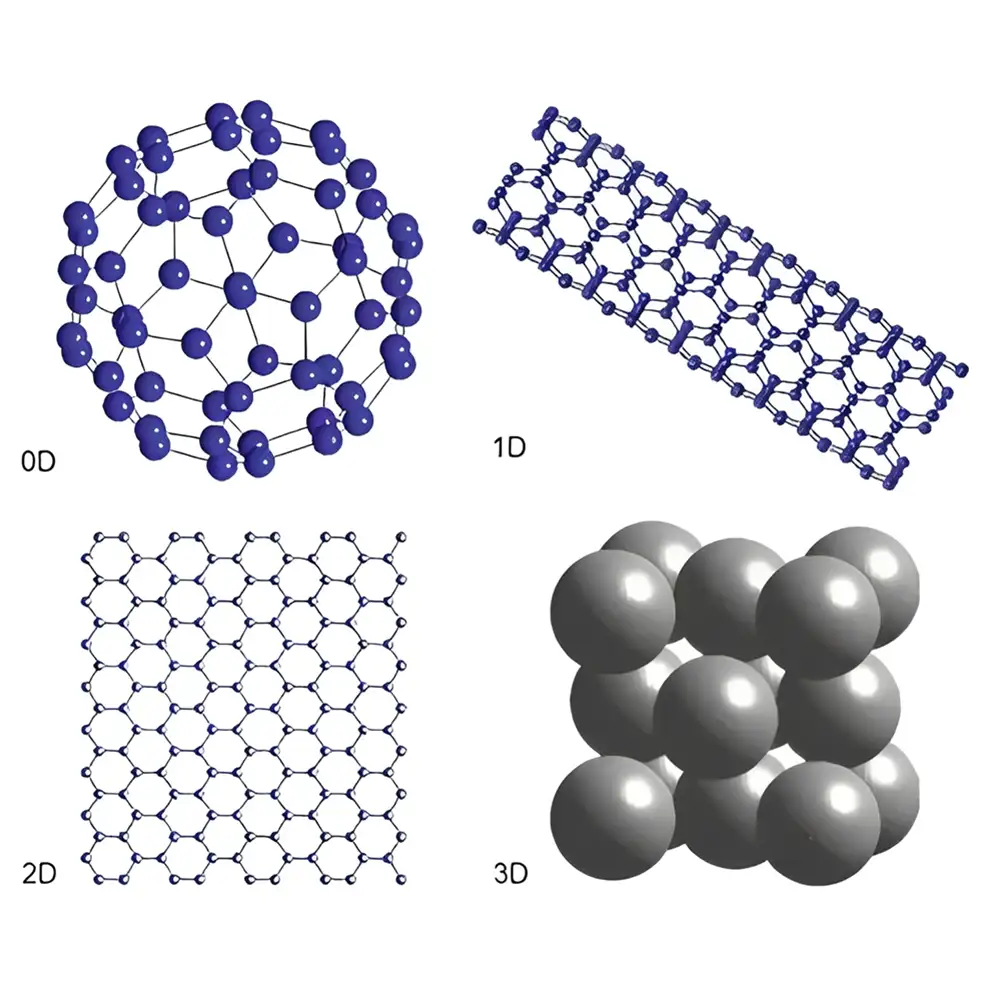
در دنیای امروز، پیشرفتهای علمی و فناوری با سرعتی بیسابقه در حال تحول است و یکی از شاخههای نوظهور که توجه پژوهشگران و پزشکان را به خود جلب کرده است، نانو تکنولوژی در پزشکی است. این شاخه از علم، با استفاده از ذرات و مواد در مقیاس نانو (یک میلیاردیم متر)، امکان طراحی سیستمهایی با کارایی و دقت فوقالعاده را در حوزه پزشکی فراهم کرده است.
نانو تکنولوژی چیست؟
نانو تکنولوژی به مطالعه، طراحی، تولید و کاربرد مواد و سیستمها در مقیاس نانو گفته میشود. در این مقیاس، خواص فیزیکی، شیمیایی و بیولوژیکی مواد تغییر کرده و ویژگیهای منحصر به فردی از جمله افزایش سطح تماس، واکنشپذیری بالاتر، تغییر رنگ و خواص مغناطیسی به وجود میآید. این ویژگیها امکان ایجاد راهکارهای نوین درمانی و تشخیصی را فراهم میکنند که پیش از این در دسترس نبودهاند.
تاریخچه نانو تکنولوژی در پزشکی به دهههای گذشته بازمیگردد، زمانی که پژوهشگران متوجه شدند کاهش اندازه ذرات میتواند قابلیت نفوذ و اثرگذاری مواد دارویی را در بدن انسان افزایش دهد. در دهه ۱۹۹۰، استفاده از لیپوزومها و نانوذرات پلیمری به عنوان حامل داروهای هدفمند، انقلابی در دارورسانی ایجاد کرد. از آن زمان تا کنون، کاربردهای نانو تکنولوژی در پزشکی به سرعت گسترش یافته و شامل حوزههایی از جمله تشخیص مولکولی، تصویربرداری پزشکی، درمان سرطان، مهندسی بافت، درمان بیماریهای قلبی و عروقی، و دارو رسانی هوشمند میشود.
یکی از ویژگیهای کلیدی نانو تکنولوژی در پزشکی، توانایی آن در ایجاد درمانهای هدفمند و شخصیسازی شده است. به عبارت دیگر، با استفاده از نانو ذرات، میتوان داروها را مستقیماً به سلولهای بیمار رساند، بدون آنکه بافتهای سالم آسیب ببینند. این موضوع، به ویژه در درمان سرطان اهمیت بالایی دارد، جایی که کاهش عوارض جانبی درمانهای شیمیدرمانی و افزایش کارایی داروهای ضدسرطان، از اولویتهای اصلی است.
نانو تکنولوژی در پزشکی تنها محدود به دارو رسانی نیست. این علم در حوزه تشخیص و تصویربرداری پزشکی نیز تحولات شگرفی ایجاد کرده است. به کمک حسگرهای نانو و نانو ذرات کنتراستدهنده، امکان شناسایی بیماریها در مراحل اولیه فراهم شده است؛ بهویژه در بیماریهایی که علائم بالینی دیر ظاهر میشوند، مانند سرطان، بیماریهای قلبی و عروقی، و اختلالات عصبی. تشخیص زودهنگام، افزایش دقت و کاهش خطای انسانی، از مزایای این فناوری است.
از طرفی، ایمنی و سمیت نانو ذرات یکی از چالشهای مهم در کاربردهای پزشکی محسوب میشود. پژوهشگران در تلاش هستند تا با استفاده از مواد بیخطر و طراحی دقیق، اثرات جانبی را کاهش دهند و استانداردهای بینالمللی را رعایت کنند. این موضوع اهمیت ویژهای دارد، زیرا ورود هر گونه ذره به بدن انسان بدون کنترل میتواند خطرات غیرمنتظرهای ایجاد کند.
مزایای کلیدی نانو تکنولوژی در پزشکی شامل موارد زیر است:
-
افزایش دقت در دارو رسانی و کاهش عوارض جانبی
-
امکان تشخیص زودهنگام بیماریها
-
توسعه درمانهای شخصیسازی شده
-
افزایش کارایی داروها و کاهش دوز مصرفی
-
امکان بازسازی و ترمیم بافتها به کمک مهندسی بافت نانو
در نهایت، نانو تکنولوژی به عنوان یک پل میان علوم فیزیک، شیمی و زیستشناسی، امکان ایجاد راهکارهای درمانی و تشخیصی هوشمند را فراهم کرده است که در آینده نزدیک، میتواند تعریف پزشکی مدرن را بازنویسی کند. با توجه به پیشرفتهای اخیر، انتظار میرود کاربردهای نانو تکنولوژی در پزشکی، نه تنها محدود به درمان بیماریها، بلکه شامل پیشگیری، بازسازی بافت، تصویربرداری مولکولی و حتی پزشکی شخصیسازی شده نیز باشد.
اصول پایهای نانو تکنولوژی در پزشکی
برای درک کامل کاربردهای نانو تکنولوژی در پزشکی، ابتدا باید اصول پایهای و ویژگیهای منحصر به فرد مواد نانو را بشناسیم. نانو تکنولوژی در پزشکی به معنای طراحی، تولید و کاربرد مواد و سیستمها در مقیاس نانو است؛ مقیاسی که یک میلیاردم متر (۱–۱۰۰ نانومتر) را شامل میشود. در این ابعاد، مواد رفتارهایی نشان میدهند که در مقیاس بزرگتر مشاهده نمیشود و این ویژگیها، اساس کاربردهای پزشکی نوین را تشکیل میدهند.
ویژگیهای اساسی مواد نانو در پزشکی
-
افزایش نسبت سطح به حجم: در مقیاس نانو، نسبت سطح به حجم ذرات بسیار افزایش مییابد. این ویژگی موجب افزایش واکنشپذیری شیمیایی و بیولوژیکی مواد شده و امکان اتصال بهتر داروها به سلولها یا مولکولهای هدف را فراهم میکند.
-
خواص نوری و مغناطیسی تغییر یافته: نانو ذرات فلزی و نیمههادی، به دلیل اثرات کوانتومی، خواص نوری و مغناطیسی خاصی از خود نشان میدهند که در تصویربرداری پزشکی و تشخیص مولکولی کاربرد دارد. به عنوان مثال، نانو ذرات طلا به دلیل سطح plasmonic خود، در روشهای تصویربرداری و درمان سرطان به کار میروند.
-
قابلیت نفوذ بالا: اندازه بسیار کوچک نانو ذرات اجازه میدهد که به راحتی از موانع بیولوژیکی عبور کنند و به سلولها، بافتها یا حتی داخل هسته سلولی دسترسی پیدا کنند. این ویژگی در دارو رسانی هدفمند و درمان بیماریهای عصبی اهمیت ویژهای دارد.
-
ویژگیهای سطحی قابل اصلاح: سطح نانو ذرات را میتوان با ترکیبات مختلف شیمیایی یا زیستی اصلاح کرد تا انتخابپذیری و اختصاصی بودن به سلولها یا بافتهای خاص افزایش یابد.
مقایسه نانو مواد با مواد سنتی
مواد در مقیاس نانو با مواد در مقیاس میکرو یا ماکرو تفاوتهای بنیادین دارند:
-
فعالیت سطحی بالا: در حالی که در مواد بزرگتر بیشتر خواص فیزیکی و شیمیایی بر اساس ساختار کلی تعیین میشود، در نانو ذرات، سطح فعال بخش بزرگی از کل ذره را تشکیل میدهد و واکنشها در سطح رخ میدهند.
-
خواص مکانیکی و حرارتی متفاوت: نانو ذرات میتوانند مقاومت، سختی و انتقال حرارت متفاوتی نسبت به همان ماده در مقیاس بزرگتر نشان دهند. این ویژگیها در ساخت دارو رسانهای مقاوم یا حسگرهای پزشکی کاربرد دارد.
-
رفتار کوانتومی: در مقیاس نانو، اثرات کوانتومی مانند تقسیم انرژی سطحی، نور فلورسانس و خواص الکترونیکی ویژه مشاهده میشود که در تصویربرداری و درمان هدفمند به کار میروند.
انواع نانو مواد مورد استفاده در پزشکی
-
نانو ذرات فلزی: شامل طلا، نقره و آهن که در درمان سرطان، تصویربرداری و دارو رسانی استفاده میشوند.
-
نانو ذرات پلیمری: مانند لیپوزومها و نانوذرات پلیمری زیستتخریبپذیر که قابلیت حمل دارو و انتشار کنترل شده را دارند.
-
نانو ذرات کربنی: شامل نانولولهها و گرافن که کاربردهای گستردهای در دارو رسانی، مهندسی بافت و حسگرهای پزشکی دارند.
-
نانو کریستالها و کوانتوم داتها: برای تصویربرداری فلورسانس و تشخیص مولکولی دقیق استفاده میشوند.
-
نانو ژلها و نانو هیدروژلها: حاملهای زیستسازگار برای دارو رسانی و ترمیم بافتها.
اصول عملکرد نانو مواد در دارو رسانی و تشخیص پزشکی
-
دارو رسانی هدفمند: نانو ذرات میتوانند داروها را مستقیماً به سلول یا بافت هدف منتقل کنند و از انتشار دارو در بافتهای سالم جلوگیری کنند. این ویژگی باعث کاهش عوارض جانبی و افزایش اثربخشی درمان میشود.
-
توزیع و انتشار کنترل شده: با اصلاح سطح نانو ذرات، میتوان زمان انتشار دارو و محل هدف را کنترل کرد، به طوری که دارو تنها در محیطهای خاص مانند محیط اسیدی تومور آزاد شود.
-
تشخیص زودهنگام بیماریها: نانو ذرات میتوانند با مولکولهای بیولوژیکی خاصی اتصال برقرار کرده و سیگنالهای قابل اندازهگیری تولید کنند که امکان تشخیص بیماری در مراحل اولیه را فراهم میآورد.
نقش مقیاس نانو در پزشکی مدرن
اندازه نانو ذرات، کلید موفقیت کاربردهای پزشکی است. ذراتی با اندازه ۱۰ تا ۱۰۰ نانومتر قادرند به راحتی وارد سلولها شوند، اما ذرات بزرگتر ممکن است توسط سیستم ایمنی بدن دفع شوند و ذرات کوچکتر از ۵ نانومتر ممکن است به سرعت از بدن خارج شوند. بنابراین، کنترل دقیق اندازه و شکل نانو ذرات برای دستیابی به اثربخشی درمانی بهینه حیاتی است.
چالشها و الزامات طراحی نانو مواد پزشکی
-
زیستسازگاری و ایمنی: نانو مواد باید بدون ایجاد سمیت یا واکنشهای التهابی در بدن عمل کنند.
-
پایداری شیمیایی و فیزیکی: نانو ذرات باید در محیطهای زیستی پایدار باشند و خواص خود را در زمان حمل و نقل دارو حفظ کنند.
-
تولید مقیاسپذیر: تولید نانو ذرات به صورت یکنواخت و با کیفیت بالا برای کاربردهای بالینی یک چالش صنعتی است.
در نهایت، درک اصول پایهای نانو تکنولوژی در پزشکی، پایهای برای تمامی کاربردهای پیشرفته این علم است، از دارو رسانی هدفمند گرفته تا مهندسی بافت، تصویربرداری پزشکی و درمان بیماریهای مزمن. با شناخت دقیق این اصول، پژوهشگران و پزشکان میتوانند راهکارهای نوین، ایمن و مؤثر برای بهبود سلامت بیماران ارائه دهند.
دارو رسانی نانو: انقلاب در درمانهای هدفمند
یکی از بزرگترین چالشهای پزشکی مدرن، رساندن دارو به محل دقیق بیماری بدون آسیب رساندن به سایر بافتهای سالم است. در بسیاری از بیماریها، بهویژه سرطان، داروهای شیمیایی علاوه بر سلولهای بیمار، سلولهای سالم را نیز تخریب میکنند و عوارض جانبی شدیدی به همراه دارند. اینجا است که نانو تکنولوژی به عنوان یک انقلاب در دارو رسانی وارد عمل میشود و امکان طراحی سیستمهای هوشمند را فراهم میکند که داروها را دقیقاً به محل مورد نظر برسانند.
مفهوم دارو رسانی هدفمند
دارو رسانی هدفمند به معنای رساندن ترکیبات درمانی به محل دقیق بیماری در بدن است، بهگونهای که دارو در بافتهای سالم آزاد نشود. فناوری نانو این امکان را با استفاده از نانو حاملها و ذرات مهندسی شده فراهم کرده است. این نانو سامانهها میتوانند دارو را محصور کرده، آن را در برابر تجزیه شدن محافظت کنند و تنها در محیط مورد نظر – مانند محیط اسیدی تومور یا بافتهای ملتهب – آزاد کنند.
مزایای دارو رسانی نانو
-
کاهش عوارض جانبی داروها به دلیل محدود شدن اثر دارو به بافت هدف
-
افزایش اثربخشی درمان با رساندن دوز کافی دارو به محل مورد نظر
-
حمل همزمان چند دارو برای ایجاد اثر همافزایی در درمان بیماریهای پیچیده
-
کنترل زمان آزادسازی دارو و افزایش ماندگاری آن در بدن
-
عبور از موانع زیستی مانند سد خونی–مغزی که معمولاً مانع ورود داروها به مغز میشود
انواع نانو سیستمهای دارو رسانی
-
لیپوزومها: ساختارهای کروی متشکل از لایههای چربی که میتوانند داروهای محلول در آب یا چربی را حمل کنند. بسیاری از داروهای ضدسرطان امروزی بر پایه لیپوزومها طراحی میشوند.
-
نانو ذرات پلیمری: نانو ذرات زیستتخریبپذیری که دارو را در خود محصور کرده و آن را به تدریج آزاد میکنند. این ذرات به دلیل سازگاری با بدن، کاربرد گستردهای در دارو رسانی دارند.
-
نانو ذرات فلزی: مانند نانو ذرات طلا یا نقره که میتوانند علاوه بر دارو رسانی، در تصویربرداری پزشکی و درمان فوتوترمال سرطان نیز به کار روند.
-
نانو ذرات کربنی: نانولولهها و گرافن که قابلیت بالایی در حمل دارو و اتصال به مولکولهای زیستی دارند.
-
نانو ژلها و هیدروژلهای نانو ساختار: که برای آزادسازی کنترلشده دارو و ترمیم بافتها استفاده میشوند.
-
کوآنتوم داتها و نانو کریستالها: که علاوه بر دارو رسانی، قابلیت ردیابی مسیر دارو در بدن را نیز فراهم میکنند.
مکانیسمهای آزادسازی دارو در نانو سیستمها
-
آزادسازی وابسته به : pH برخی نانو ذرات طوری طراحی میشوند که تنها در محیطهای اسیدی (مانند بافت تومور) دارو را آزاد کنند.
-
آزادسازی وابسته به دما: نانو ذرات حساس به گرما میتوانند دارو را در دمای خاصی آزاد کنند، به عنوان مثال هنگام گرمادهی موضعی با لیزر.
-
آزادسازی وابسته به آنزیمها: برخی نانو ذرات در حضور آنزیمهای خاصی که در محل بیماری فعالاند، تخریب شده و دارو را آزاد میکنند.
-
آزادسازی زمانبندی شده: با طراحی دقیق، میتوان سرعت آزادسازی دارو را کنترل کرد تا به صورت تدریجی وارد جریان خون شود.
کاربردهای بالینی دارو رسانی نانو
-
درمان سرطان: مهمترین کاربرد دارو رسانی نانو، انتقال داروهای ضدسرطان به سلولهای سرطانی است. به عنوان مثال، داروی دوکسوروبیسین در قالب نانو لیپوزومها با موفقیت برای درمان سرطان تخمدان و سینه استفاده شده است.
-
درمان بیماریهای عصبی: نانو ذرات میتوانند از سد خونی–مغزی عبور کنند و داروهای درمانی برای آلزایمر، پارکینسون و تومورهای مغزی را به مقصد برسانند.
-
درمان بیماریهای قلبی و عروقی: دارو رسانی نانو میتواند برای انتقال داروهای ضدترومبوز یا ترمیم بافتهای قلبی پس از سکته استفاده شود.
-
مبارزه با عفونتهای مقاوم به آنتیبیوتیک: نانو ذرات نقره و پلیمری به عنوان سیستمهای ضدباکتریایی هوشمند مورد توجه قرار گرفتهاند.
-
ژنتیک و ژندرمانی: نانو ذرات حامل DNA یا RNA میتوانند برای اصلاح ژنتیکی سلولها و درمان بیماریهای ارثی به کار روند.
دارو رسانی نانو و پزشکی شخصیسازی شده
یکی از جذابترین جنبههای نانو تکنولوژی در پزشکی، نقش آن در پزشکی فردمحور یا شخصیسازی شده است. با استفاده از نانو ذرات میتوان داروهایی طراحی کرد که بر اساس ویژگیهای ژنتیکی و متابولیکی هر فرد عمل کنند. این موضوع انقلابی در درمان بیماریهای مزمن و پیچیده محسوب میشود و میتواند جایگزین روشهای سنتی یکسان برای همه بیماران شود.
چالشها و محدودیتها در دارو رسانی نانو
با وجود مزایای فراوان، دارو رسانی نانو با چالشهایی نیز روبهرو است:
-
ایمنی و سمیت نانو ذرات که نیاز به مطالعات طولانیمدت دارد.
-
مشکلات تولید صنعتی در مقیاس بزرگ و اطمینان از یکنواختی ذرات.
-
هزینههای بالای تحقیق و توسعه در این حوزه.
-
پذیرش بالینی و قوانین سختگیرانه دارویی که ورود این فناوری به بازار را کند میکند.
در نتیجه، دارو رسانی نانو یک تحول بنیادین در پزشکی مدرن به شمار میرود که با کاهش عوارض جانبی، افزایش اثربخشی درمان و امکان پزشکی شخصیسازی شده، مسیر جدیدی برای درمان بیماریهای پیچیده گشوده است. با رفع چالشهای موجود، آینده دارو رسانی نانو میتواند پزشکی را به سطحی برساند که درمانها کاملاً هوشمند، ایمن و اختصاصی باشند.
نانو در تشخیص پزشکی: ابزارهای نوین برای شناسایی بیماریها
تشخیص پزشکی به عنوان یکی از پایههای اصلی علم پزشکی، نقش کلیدی در شناسایی زودهنگام بیماریها و انتخاب مناسبترین راهکار درمانی دارد. هرچه بیماریها در مراحل اولیه تشخیص داده شوند، شانس درمان مؤثر و جلوگیری از عوارض ناشی از پیشرفت آنها افزایش مییابد. در این میان، نانو تکنولوژی توانسته تحولی بنیادین در روشهای تشخیصی ایجاد کند و ابزارهایی با حساسیت و دقت بیسابقه در اختیار پزشکان قرار دهد.
یکی از مهمترین مزیتهای استفاده از فناوری نانو در تشخیص پزشکی، توانایی شناسایی تغییرات مولکولی و سلولی پیش از ظهور علائم بالینی است. این بدان معناست که بیماریها در مراحل بسیار ابتدایی، حتی پیش از ایجاد آسیب جدی در بافتها، قابل شناسایی خواهند بود. در این بخش به مهمترین کاربردها و دستاوردهای نانو در حوزه تشخیص پزشکی پرداخته میشود.
نانوذرات به عنوان عاملهای تشخیصی
نانوذرات، به دلیل سطح ویژه بالا و قابلیت اصلاح سطحی، به گونهای طراحی میشوند که بتوانند به مولکولها یا سلولهای خاص متصل شوند. برای مثال:
-
نانوذرات طلا به دلیل ویژگیهای نوری منحصر به فرد، در شناسایی بیومارکرهای سرطان مورد استفاده قرار میگیرند. زمانی که این ذرات به یک آنتیژن خاص متصل شوند، تغییر در الگوهای پراکندگی نور امکان شناسایی حضور سلولهای سرطانی را فراهم میسازد.
-
کوانتوم داتها یا نقاط کوانتومی، نانوکریستالهایی نیمههادی هستند که خواص فلورسانس قوی و پایدار دارند. این نقاط بهویژه در تصویربرداری سلولی و ردیابی مسیرهای مولکولی استفاده میشوند.
نانو بیوسنسورها
یکی از نوآوریهای بزرگ نانو تکنولوژی در تشخیص پزشکی، طراحی نانو بیوسنسورها است. این ابزارها توانایی شناسایی غلظتهای بسیار پایین از بیومارکرها را دارند.
-
بیوسنسورهای مبتنی بر نانولولههای کربنی قادر به تشخیص مولکولهای گلوکز با دقت بسیار بالا هستند و در مدیریت بیماری دیابت تحولی ایجاد کردهاند.
-
استفاده از نانوذرات مغناطیسی در بیوسنسورها امکان جداسازی و شناسایی سلولهای خاص مانند سلولهای توموری در نمونههای خون را فراهم میسازد.
این بیوسنسورها نه تنها سرعت تشخیص را افزایش میدهند، بلکه نیاز به نمونهگیریهای تهاجمی را نیز کاهش میدهند.
تصویربرداری پزشکی پیشرفته با کمک نانو
تصویربرداری پزشکی همواره یکی از ابزارهای اصلی برای تشخیص بیماریها بوده است. ورود فناوری نانو باعث افزایش چشمگیر دقت و وضوح تصاویر پزشکی شده است.
-
نانولولهها و نانوذرات فلورسنت در بهبود کیفیت تصاویر حاصل از MRI، CT و PET نقش مهمی دارند. به عنوان نمونه، استفاده از نانوذرات اکسید آهن به عنوان ماده حاجب در MRI باعث افزایش وضوح تصاویر و شناسایی تومورهای کوچک میشود.
-
نقاط کوانتومی با ویژگیهای فلورسانس طولانیمدت، امکان تصویربرداری سلولهای منفرد و حتی اجزای درونسلولی را فراهم کردهاند.
شناسایی سریع بیماریهای عفونی
با توجه به تهدیدات جهانی ناشی از بیماریهای واگیردار، توسعه ابزارهای تشخیصی سریع و دقیق اهمیت زیادی دارد. فناوری نانو در این حوزه نیز تحولآفرین بوده است.
-
نانو بیوسنسورهای مبتنی بر طلا و نقره قادر به شناسایی ویروسهایی مانند HIV یا ویروس کرونا در مدت زمان بسیار کوتاه هستند.
-
کیتهای نانویی قابل حمل، امکان تشخیص بیماری در محل و بدون نیاز به تجهیزات آزمایشگاهی پیشرفته را فراهم کردهاند. این مسئله در مناطق دورافتاده و فاقد امکانات پزشکی حیاتی است.
نانو و پزشکی شخصی
فناوری نانو در تشخیص پزشکی، ارتباط مستقیمی با پزشکی شخصی دارد. با استفاده از ابزارهای نانویی، میتوان پروفایل مولکولی هر فرد را شناسایی کرد و متناسب با ویژگیهای ژنتیکی و بیوشیمیایی او، روشهای درمانی خاصی تجویز نمود. این رویکرد، علاوه بر افزایش اثربخشی درمان، احتمال بروز عوارض جانبی را نیز کاهش میدهد.
آینده نانو در تشخیص پزشکی
با پیشرفتهای مداوم در حوزه نانو، آینده تشخیص پزشکی به سمت ابزارهای کوچکتر، سریعتر و دقیقتر حرکت خواهد کرد. انتظار میرود که در سالهای آینده، دستگاههای نانویی قادر باشند تنها با چند قطره خون یا حتی نمونه بزاق، دهها بیماری مختلف را در مدت چند دقیقه شناسایی کنند.
در مجموع، نانو تکنولوژی در تشخیص پزشکی نه تنها باعث ارتقای حساسیت و دقت ابزارهای تشخیصی شده است، بلکه امکان شناسایی زودهنگام بیماریها را نیز فراهم آورده است. این پیشرفتها مسیر را به سوی پزشکی هوشمند، پیشگیرانه و شخصیسازیشده هموار میسازد.
نانو در درمان سرطان: راهی به سوی درمانهای دقیقتر
سرطان یکی از چالشبرانگیزترین بیماریهای عصر حاضر است که علیرغم پیشرفتهای گسترده در روشهای تشخیص و درمان، همچنان بهعنوان یکی از علل اصلی مرگومیر در جهان شناخته میشود. درمانهای رایج مانند شیمیدرمانی، پرتودرمانی و جراحی هرچند در بسیاری از موارد موثر واقع میشوند، اما محدودیتهای قابلتوجهی دارند؛ از جمله آسیب به سلولهای سالم، عوارض جانبی شدید و در برخی موارد بازگشت تومور. در چنین شرایطی، نانو تکنولوژی بهعنوان ابزاری نوین و تحولآفرین وارد عرصه شده و مسیر تازهای را برای دستیابی به درمانهای دقیقتر و شخصیسازیشده هموار ساخته است.
نانو درمانهای سرطان بر پایه طراحی و استفاده از نانوذرات، نانو حاملها و نانو حسگرها شکل گرفتهاند که میتوانند با هدف گیری سلولهای سرطانی، انتقال دارو بهصورت کنترلشده و به حداقل رساندن آسیب به بافتهای سالم، کیفیت درمان را بهطور چشمگیری افزایش دهند.
چالشهای روشهای سنتی درمان سرطان
برای درک اهمیت نانو تکنولوژی در درمان سرطان، باید ابتدا محدودیتهای روشهای سنتی مرور شوند. در شیمیدرمانی معمولی، داروهای ضدسرطان در سراسر بدن پخش میشوند، بدون آنکه تفاوتی میان سلولهای سالم و سرطانی قائل شوند. این امر سبب بروز عوارض جانبی شدید مانند ریزش مو، تهوع، سرکوب سیستم ایمنی و حتی آسیب به اندامهای حیاتی میشود. همچنین بسیاری از تومورها در برابر این داروها مقاومت نشان میدهند و پس از مدتی رشد مجدد دارند.
پرتودرمانی نیز با وجود کارآمدی نسبی، بهدلیل ماهیت پرتوها ممکن است سلولهای سالم اطراف بافت سرطانی را تخریب کند و منجر به ایجاد مشکلات ثانویه شود. در جراحی هم امکان برداشتن کامل تومور همیشه وجود ندارد، بهویژه اگر سرطان به نواحی حساس یا گستردهای از بدن گسترش یافته باشد.
بنابراین نیاز به راهکارهایی که بتوانند درمان دقیقتر، با حداقل عوارض جانبی و بیشترین کارایی را ارائه دهند، بیش از پیش احساس میشود.
نقش نانو تکنولوژی در بهبود درمان سرطان
نانو تکنولوژی توانسته است با طراحی سیستمهای نوآورانه، مشکلات اساسی درمانهای رایج را کاهش دهد. مهمترین مزایای آن در حوزه سرطان عبارتند از:
-
هدفگیری اختصاصی سلولهای سرطانی از طریق نانوذرات پوشش دادهشده با لیگاندها، آنتیبادیها یا پپتیدهایی که گیرندههای خاص بر سطح سلولهای سرطانی را شناسایی میکنند.
-
رهاسازی کنترلشده دارو که اجازه میدهد دوز دارو در محل تومور افزایش یابد، در حالی که میزان آن در سایر بافتها به حداقل برسد.
-
افزایش نفوذ داروها در تومورها بهواسطه اندازه نانومتری حاملها که امکان عبور از دیوارههای غیرطبیعی رگهای تومور (اثر نفوذ و ماندگاری افزایشیافته یا (EPR را فراهم میکند.
-
کاهش مقاومت دارویی با رساندن ترکیبی از چند دارو به سلولهای سرطانی یا استفاده از نانوذراتی که مسیرهای مقاومت را مسدود میکنند.
-
امکان ترکیب درمان و تشخیص (تراپانستیک(، بهگونهای که یک نانوذره همزمان داروی ضدسرطان را منتقل کرده و وضعیت پاسخدهی تومور را نیز نشان دهد.
نانو حاملها در درمان سرطان
نانو حاملهای دارویی بهعنوان یکی از مهمترین دستاوردهای نانو تکنولوژی در درمان سرطان شناخته میشوند. این حاملها میتوانند داروهای شیمیدرمانی یا عوامل ژنتیکی را با کارایی بالا به تومور منتقل کنند. مهمترین نانو حاملها عبارتند از:
-
لیپوزومها: وزیکولهای کروی از جنس لیپید که قادر به بارگذاری داروهای محلول در آب یا چربی هستند. نمونه بارز آن دوکسوروبیسین لیپوزومی (Doxil®) است که توانسته عوارض شیمیدرمانی را بهطور محسوسی کاهش دهد.
-
نانوذرات پلیمری: ساختارهای زیستتخریبپذیر با قابلیت کنترل بر رهاسازی دارو و تغییر سطح برای هدفگیری اختصاصی.
-
نانوذرات فلزی (مانند طلا و آهن اکسید: ( علاوه بر رساندن دارو، در هایپرترمیای مغناطیسی یا فوتوترمال نیز بهکار میروند و با افزایش موضعی دما، سلولهای سرطانی را از بین میبرند.
-
دندریمرها: پلیمرهای شاخهای با ظرفیت بارگذاری چندگانه که برای حمل دارو یا ژن بهکار میروند.
-
نانوذرات زیستی (مانند پروتئینها و پلیساکاریدها) : حاملهایی با سازگاری زیستی بالا و کمترین اثرات سمی.
نانو درمانهای ترکیبی و شخصیسازیشده
یکی از بزرگترین فرصتهایی که نانو تکنولوژی ایجاد کرده، امکان درمان ترکیبی است. بهعنوان مثال، یک نانوذره میتواند همزمان داروی شیمیدرمانی و یک عامل حساس به نور را حمل کند؛ در نتیجه هنگام تابش نور لیزر، اثر درمانی دوچندان میشود. این رویکرد که به آن فتودینامیک تراپی (PDT) گفته میشود، در بسیاری از سرطانها در حال بررسی است.
همچنین، با توجه به تفاوتهای ژنتیکی و مولکولی میان بیماران، نانو سیستمها میتوانند بهسمت درمانهای شخصیسازیشده حرکت کنند؛ به این معنا که نوع و ترکیب داروها متناسب با ویژگیهای بیولوژیکی هر بیمار انتخاب و منتقل شوند.
آینده نانو درمان سرطان
با وجود پیشرفتهای چشمگیر، هنوز چالشهایی مانند ایمنی طولانیمدت نانوذرات، هزینه تولید بالا، و پیچیدگی در تاییدهای بالینی وجود دارد. با این حال، روند تحقیقات و ورود برخی از محصولات نانویی به بازار، نویدبخش آن است که در آینده نزدیک، درمان سرطان با دقتی بیسابقه و عوارضی بسیار کمتر امکانپذیر خواهد بود.
نانو تکنولوژی نهتنها امید به بهبود بیماران سرطانی را افزایش داده، بلکه راه را برای تحولی بنیادین در علم پزشکی هموار ساخته است.
نانو در درمان بیماریهای قلبی و عروقی
بیماریهای قلبی و عروقی همچنان یکی از اصلیترین علل مرگ و میر در سراسر جهان محسوب میشوند. روشهای درمانی سنتی مانند مصرف داروهای ضد انعقاد، استاتینها یا جراحیهای تهاجمی همچون آنژیوپلاستی و بایپس قلبی، گرچه اثربخشی بالایی دارند اما همواره با عوارض جانبی، هزینههای بالا و محدودیتهای عملکردی همراه هستند. در این میان، نانو تکنولوژی چشمانداز جدیدی برای درمانهای هدفمند و دقیقتر در بیماریهای قلبی و عروقی فراهم کرده است. این فناوری با امکان طراحی سامانههای دارورسانی هوشمند، تشخیص زودهنگام ضایعات و بازسازی بافتهای آسیبدیده، میتواند تحولی بنیادین در پزشکی قلب ایجاد کند.
نقش نانوذرات در درمان آترواسکلروز
یکی از مهمترین عوامل بروز بیماریهای قلبی، تشکیل پلاکهای آترواسکلروتیک در دیواره عروق است. درمانهای رایج مبتنی بر داروهای کاهنده کلسترول یا ضد التهابی، غالباً به صورت سیستمیک عمل میکنند و ممکن است منجر به عوارض در سایر بافتها شوند. اما نانوذرات قادرند داروها را بهطور اختصاصی به محل تجمع پلاک هدایت کنند. به عنوان نمونه:
-
لیپوزومهای هدفمند میتوانند داروهای ضدالتهابی یا آنتیاکسیدانها را مستقیماً به پلاکها برسانند و موجب کاهش التهاب موضعی شوند.
-
نانوذرات پلیمری با پوششهای زیستسازگار، قادرند داروهای کاهنده کلسترول را با سرعت کنترلشده آزاد کنند و به کاهش ضخامت پلاک کمک نمایند.
-
نانوذرات مغناطیسی نیز با هدایت خارجی از طریق میدان مغناطیسی، به نواحی خاص عروقی هدایت شده و دارورسانی دقیقتری فراهم میکنند.
این روشها نهتنها موجب افزایش کارایی درمان میشوند بلکه احتمال بروز عوارض جانبی دارو را نیز به میزان قابل توجهی کاهش میدهند.
نانو در بازسازی بافت قلب پس از سکته
پس از سکته قلبی، بخش قابل توجهی از بافت میوکارد آسیب دیده و توانایی ترمیم طبیعی آن محدود است. در این شرایط، نانو تکنولوژی میتواند با ایجاد محیطی مناسب برای بازسازی بافت، عملکرد قلب را بهبود بخشد. برخی از رویکردهای مهم در این زمینه عبارتند از:
-
اسک affoldهای نانوفیبری که بهعنوان داربست سهبعدی برای رشد سلولهای بنیادی عمل کرده و بازسازی بافت قلب را تسهیل میکنند.
-
هیدروژلهای نانوساختاری که با تقلید از ماتریکس خارج سلولی، محیطی زیستسازگار برای رشد سلولهای قلبی فراهم میکنند.
-
نانوذرات حامل فاکتورهای رشد که بهصورت موضعی در ناحیه انفارکتوس آزاد میشوند و روند آنژیوژنز (تشکیل رگهای خونی جدید) را تحریک میکنند.
این رویکردها، راهکاری نوین برای کاهش اسکار بافتی و بازیابی عملکرد قلب به شمار میروند.
کاربرد نانو در استنتهای قلبی
استنتهای دارویی یکی از پرکاربردترین روشها برای درمان گرفتگی عروق کرونری هستند. با این حال، مشکلاتی مانند ترومبوز دیررس یا رشد مجدد بافت در محل استنت همچنان چالشبرانگیز است. فناوری نانو در این حوزه راهکارهایی نوین ارائه داده است:
-
استفاده از پوششهای نانوساختاری زیستفعال روی استنتها برای کاهش لختهزایی.
-
طراحی نانوپوششهای هوشمند که داروهای ضدتکثیر سلولی را بهطور کنترلشده آزاد میکنند و از انسداد مجدد جلوگیری مینمایند.
-
بهکارگیری استنتهای زیستتخریبپذیر با ساختار نانویی که پس از باز نگه داشتن رگ، به تدریج جذب بدن میشوند و خطر عوارض طولانیمدت را کاهش میدهند.
نانو برای تشخیص زودهنگام بیماریهای قلبی
یکی از مهمترین مزایای نانو تکنولوژی، امکان تشخیص زودهنگام و دقیق بیماریهای قلبی و عروقی است. نانوبیوسنسورها قادرند تغییرات مولکولی و بیوشیمیایی بسیار کوچک را شناسایی کنند. برای مثال:
-
نانوذرات طلا در کیتهای بیوسنسوری برای شناسایی بیومارکرهای قلبی مانند تروپونین استفاده میشوند و امکان تشخیص سریع حمله قلبی را فراهم میکنند.
-
نانولولههای کربنی و گرافن بهعنوان مواد رسانای بسیار حساس، در طراحی حسگرهای الکتروشیمیایی برای شناسایی تغییرات متابولیکی سلولهای قلبی کاربرد دارند.
-
پلتفرمهای نانوفلوئیدیک نیز قادرند مقادیر بسیار اندک پروتئینها یا DNA مرتبط با بیماریهای عروقی را در نمونههای خونی شناسایی کنند.
این ابزارها زمینهساز پزشکی پیشگیرانه و مداخلات زودهنگام در بیماران پرخطر خواهند بود.
چالشها و آیندهنگری
با وجود پیشرفتهای چشمگیر، استفاده از نانو تکنولوژی در درمان بیماریهای قلبی و عروقی با چالشهایی نیز مواجه است. مسائلی همچون ایمنی زیستی نانوذرات، تجمع آنها در اندامهای غیرهدف، هزینههای بالا و الزامات پیچیده تنظیمگری نیازمند بررسی دقیق هستند. با این حال، تحقیقات گسترده در حال انجام است و انتظار میرود طی سالهای آینده شاهد ورود گستردهتر این فناوری به حوزه درمانهای بالینی قلب و عروق باشیم.
به طور کلی، نانو تکنولوژی با فراهمسازی ابزارهایی برای تشخیص سریعتر، درمان هدفمندتر و بازسازی مؤثرتر بافتهای قلبی، میتواند آیندهای نویدبخش برای بیماران قلبی رقم بزند و محدودیتهای درمانهای سنتی را تا حد زیادی برطرف سازد.
نانو در درمان بیماریهای عصبی و مغزی
بیماریهای عصبی و مغزی به دلیل ساختار پیچیده سیستم عصبی مرکزی و محدودیتهای بیولوژیکی، از جمله سد خونی-مغزی، همواره یکی از بزرگترین چالشهای پزشکی محسوب میشوند. بسیاری از داروهای متداول قادر به عبور از این سد نیستند و در نتیجه اثربخشی آنها در درمان بیماریهای عصبی به شدت کاهش مییابد. در این میان، نانو تکنولوژی به عنوان یک رویکرد تحولآفرین توانسته است راهکارهای نوینی برای عبور از این مانع و ارائه درمانهای مؤثرتر معرفی کند.
سد خونی-مغزی همانند یک فیلتر محافظ عمل میکند و تنها مواد خاصی را اجازه عبور به مغز میدهد. این مکانیسم اگرچه از نظر بیولوژیکی برای محافظت از مغز بسیار حیاتی است، اما در عین حال مانع مهمی در رساندن داروها و مواد درمانی به بافت عصبی محسوب میشود. نانو ذرات با ویژگیهای منحصر به فرد خود، از جمله اندازه بسیار کوچک، قابلیت اصلاح سطحی، و توانایی بارگذاری دارو، توانستهاند این محدودیت را تا حد زیادی برطرف کنند.
کاربرد نانو در درمان بیماریهای عصبی را میتوان در چند محور اصلی بررسی کرد:
دارورسانی هدفمند به مغز
یکی از مهمترین کاربردهای نانو تکنولوژی در علوم اعصاب، دارورسانی هدفمند است. نانوذرات با طراحی مناسب میتوانند از سد خونی-مغزی عبور کرده و داروها را به نواحی خاصی از مغز برسانند. این رویکرد در درمان بیماریهایی همچون آلزایمر، پارکینسون و صرع اهمیت ویژهای دارد. برای مثال، استفاده از نانوذرات لیپیدی و پلیمرهای زیستسازگار باعث شده داروهای ضدآلزایمر با کارایی بیشتری به نورونها برسند و اثرات تخریبی پروتئینهای آمیلوئید کاهش یابد.
نانوذرات در تشخیص بیماریهای عصبی
نانوذرات فلزی مانند نانوذرات طلا و نقره به دلیل ویژگیهای نوری و الکترونیکی خاص خود، در تصویربرداری مغزی و شناسایی اولیه بیماریهای عصبی به کار گرفته میشوند. این نانوذرات میتوانند به عنوان کنتراستافزار در روشهای تصویربرداری مانند MRI و PET عمل کنند و امکان شناسایی زودهنگام تغییرات بافتی و پروتئینی در مغز را فراهم آورند. تشخیص زودهنگام به ویژه در بیماریهایی چون آلزایمر اهمیت حیاتی دارد زیرا درمان در مراحل ابتدایی مؤثرتر خواهد بود.
نانو در بازسازی بافتهای عصبی
یکی دیگر از حوزههای نویدبخش، بازسازی بافتهای آسیبدیده عصبی است. تحقیقات نشان دادهاند که استفاده از نانو فیبرها و داربستهای نانوساختاری میتواند در رشد مجدد نورونها و بازسازی مسیرهای عصبی آسیبدیده مؤثر باشد. این فناوری میتواند در آینده برای درمان آسیبهای نخاعی و بازگرداندن عملکرد حرکتی به بیماران مورد استفاده قرار گیرد.
نانوحسگرها در علوم اعصاب
نانوحسگرها ابزارهای دقیقی هستند که میتوانند تغییرات بسیار کوچک در محیط مغزی را ردیابی کنند. این حسگرها قابلیت شناسایی نوروترنسمیترها، یونها و بیومارکرهای عصبی را دارند. چنین فناوریهایی میتواند در پایش لحظهای عملکرد مغز، شناسایی نامتعادل بودن انتقالدهندههای عصبی و حتی کمک به توسعه درمانهای شخصیسازی شده به کار رود.
درمان اختلالات حرکتی و روانی
در بیماریهایی مانند پارکینسون، یکی از مهمترین چالشها رساندن داروهای دوپامین یا آگونیستهای آن به مغز است. نانوذرات پلیمری و لیپوزومی توانستهاند با انتقال هدفمند این ترکیبات، کارایی درمانی را افزایش دهند. همچنین در درمان اختلالات روانی نظیر افسردگی مقاوم به درمان، استفاده از نانوحاملها برای رساندن داروهای ضدافسردگی به مغز نتایج امیدوارکنندهای داشته است.
چالشها و محدودیتها
با وجود مزایای متعدد، استفاده از نانو تکنولوژی در درمان بیماریهای عصبی با چالشهایی روبهروست. ایمنی نانوذرات، پایداری زیستی، احتمال تجمع در بافتها و دشواری در کنترل دقیق مسیر حرکت آنها از جمله موانعی است که نیازمند تحقیقات بیشتر میباشد. همچنین مسائل اخلاقی در کاربرد نانوفناوریهای مرتبط با مغز نیز مورد توجه محققان و سیاستگذاران قرار گرفته است.
در مجموع، نانو تکنولوژی افقهای تازهای برای درمان بیماریهای عصبی و مغزی گشوده است. این فناوری میتواند با ترکیب دارورسانی هدفمند، تشخیص دقیق، بازسازی بافتهای آسیبدیده و پایش لحظهای عملکرد عصبی، به توسعه درمانهای مؤثرتر و شخصیسازیشده منجر شود. آینده درمان بیماریهای عصبی به شدت به پیشرفتهای نانوفناوری وابسته خواهد بود و انتظار میرود در سالهای پیش رو، بسیاری از بیماریهای عصبی که تاکنون غیرقابلدرمان تلقی میشدند، با کمک این فناوری به شکل مؤثرتری مدیریت شوند.
نانو در درمان بیماریهای عفونی و باکتریایی
بیماریهای عفونی و باکتریایی همچنان یکی از بزرگترین تهدیدها برای سلامت عمومی در سراسر جهان محسوب میشوند. ظهور سویههای مقاوم به آنتیبیوتیک و محدودیت روشهای درمانی موجود، نیاز به راهکارهای نوین و مؤثر را بیش از پیش نمایان ساخته است. در این میان، فناوری نانو با ارائه ابزارها و سامانههای نوین توانسته است افقهای جدیدی در درمان این بیماریها بگشاید و امید به مقابله با مقاومت دارویی و عفونتهای مزمن را افزایش دهد.
چالش مقاومت دارویی و ضرورت استفاده از نانو
یکی از بزرگترین مشکلات در درمان بیماریهای عفونی، پدیده مقاومت آنتیبیوتیکی است که بر اثر مصرف بیرویه یا نادرست داروها بهوجود میآید. در این شرایط، باکتریها توانایی مقابله با دارو را پیدا کرده و درمان با شکست مواجه میشود. فناوری نانو با استفاده از نانوذرات فلزی مانند نقره، طلا، روی و مس و همچنین نانو حاملهای دارویی مانند لیپوزومها و پلیمرهای زیستتخریبپذیر، توانسته است رویکردهای جدیدی برای غلبه بر این چالش ارائه دهد. نانوذرات علاوه بر اثر مستقیم ضدمیکروبی، میتوانند بهعنوان ناقل دارو عمل کرده و غلظت مؤثر دارو را در محل عفونت افزایش دهند.
نانوذرات فلزی با خاصیت ضدمیکروبی
نانوذرات نقره از دیرباز بهعنوان مؤثرترین ترکیبات ضدباکتریایی شناخته شدهاند. این نانوذرات از طریق مکانیسمهایی همچون تخریب غشای سلولی باکتریها، تولید گونههای فعال اکسیژن (ROS)، و اختلال در فرآیندهای متابولیکی قادر به نابودی میکروارگانیسمها هستند. همچنین به دلیل اندازه کوچک و سطح فعال بالا، اثرگذاری آنها چندین برابر ترکیبات ماکروسکوپی است.
بهطور مشابه، نانوذرات اکسید روی و اکسید مس نیز بهعنوان عوامل ضدمیکروبی قدرتمند معرفی شدهاند که میتوانند در پوششهای پزشکی، پانسمانها و حتی ابزارهای جراحی مورد استفاده قرار گیرند.
نانو حاملهای دارویی برای درمان هدفمند عفونت
استفاده از لیپوزومها، نانوامولسیونها، و پلیمرهای هوشمند بهعنوان حاملهای دارو، رویکردی پیشرفته در درمان عفونتهاست. این سامانهها دارو را بهطور مستقیم به محل عفونت منتقل کرده و از انتشار گسترده آن در بدن جلوگیری میکنند. نتیجه این فرآیند، افزایش کارایی دارو و کاهش عوارض جانبی است. بهعنوان نمونه، لیپوزومهای بارگذاریشده با آنتیبیوتیکها توانستهاند در درمان عفونتهای ریوی ناشی از باکتری سودوموناس آئروژینوزا نتایج امیدوارکنندهای نشان دهند.
نانو در مقابله با بیوفیلمهای باکتریایی
یکی از چالشهای بزرگ در درمان عفونتها، تشکیل بیوفیلمهای باکتریایی است. بیوفیلمها ساختارهایی مقاوم و پیچیده هستند که باکتریها را در برابر نفوذ آنتیبیوتیکها و سیستم ایمنی محافظت میکنند. نانوذرات با توانایی نفوذ بالا و قابلیت تخریب دیواره سلولی، قادرند این بیوفیلمها را از بین ببرند. علاوه بر این، نانوحاملهای هوشمند میتوانند دارو را بهطور انتخابی در نواحی بیوفیلم آزاد کرده و اثربخشی درمان را افزایش دهند.
نانو در درمان بیماریهای ویروسی و قارچی
اگرچه تمرکز اصلی بر درمان عفونتهای باکتریایی است، اما فناوری نانو در مقابله با بیماریهای ویروسی و قارچی نیز نقشآفرینی کرده است. برای مثال، نانوذرات طلا و نقره توانستهاند تکثیر برخی ویروسها مانند HIV و ویروس آنفلوآنزا را مهار کنند. همچنین، نانوسامانههای بر پایه پلیمرهای زیستسازگار، داروهای ضدقارچ را با پایداری بیشتر و اثربخشی بالاتر به محل عفونت منتقل میکنند.
کاربردهای بالینی و چشمانداز آینده
امروزه استفاده از نانوذرات در پانسمانهای ضدباکتریایی، کاتترهای پزشکی پوششدادهشده با نانوذرات نقره، و داروهای نانوساختار برای عفونتهای مقاوم وارد مراحل بالینی شده است. پیشبینی میشود در آینده نزدیک، درمان بیماریهای عفونی بهطور گستردهای بر پایه فناوری نانو بنا شود. با این حال، همچنان نگرانیهایی درباره ایمنی، سمیت طولانی مدت، و پایداری نانوذرات در بدن وجود دارد که نیازمند پژوهشهای گستردهتر است.
در یک جمعبندی، میتوان گفت فناوری نانو با ارائه ابزارهای نوین توانسته است در زمینه درمان بیماریهای عفونی و باکتریایی، بهویژه در مبارزه با مقاومت آنتیبیوتیکی، انقلابی اساسی در پزشکی مدرن ایجاد کند. استفاده از نانوذرات فلزی، نانوحاملهای هوشمند، و کاربرد آنها در تجهیزات پزشکی نوین، نویدبخش آیندهای است که در آن درمان عفونتها با سرعت، دقت و اثربخشی بسیار بیشتری انجام خواهد شد.
نانو در ترمیم بافتها و مهندسی بافت
ترمیم بافتها و بازسازی ارگانهای آسیبدیده همواره یکی از بزرگترین چالشهای پزشکی مدرن بوده است. مهندسی بافت بهعنوان یک حوزه میانرشتهای، ترکیبی از علوم زیستی، مواد، پزشکی و مهندسی است که به دنبال یافتن راهکارهایی برای جایگزینی یا بازسازی بافتهای آسیبدیده میباشد. در این میان، نانو فناوری توانسته تحولی عظیم در این حوزه ایجاد کند و مسیرهای نوینی برای بازسازی بافتها و اندامهای بدن فراهم آورد. استفاده از نانوذرات، نانوالیاف، نانوکامپوزیتها و نانو داربستها سبب شده تا بازسازی بافتها با شباهت بیشتر به شرایط طبیعی بدن انجام شود و کارایی درمانی به شکل قابل توجهی افزایش یابد.
نقش نانو مواد در داربستهای مهندسی بافت
داربستها در مهندسی بافت بهعنوان ساختارهای سهبعدی عمل میکنند که سلولها میتوانند روی آنها رشد کرده و تکثیر یابند. نانومواد به دلیل شباهت ساختاری با ماتریکس خارج سلولی (ECM) نقش کلیدی در ساخت داربستهای زیستی دارند. نانوالیاف پلیمرهای زیستتخریبپذیر مانند پلیکاپرولاکتون (PCL)، پلیلاکتیکاسید (PLA) یا پلیاتیلنگلیکول (PEG) بهوسیله روشهایی مانند الکتروریسی تولید میشوند و بستری مناسب برای رشد سلولهای بنیادی فراهم میکنند. این داربستها نهتنها به دلیل سطح ویژه بالا، امکان اتصال بهتر سلولها را ایجاد میکنند، بلکه با اعمال تغییرات شیمیایی و افزودن نانوذرات زیستفعال مانند هیدروکسیآپاتیت یا نانو سیلیکا میتوان خواص مکانیکی و زیستی آنها را ارتقا داد.
استفاده از نانوذرات برای تحریک بازسازی بافت
یکی از مزایای اصلی نانوفناوری در مهندسی بافت، قابلیت استفاده از نانوذرات فعال زیستی است که میتوانند سیگنالهای بیوشیمیایی مشابه بدن را شبیهسازی کنند. برای مثال، نانوذرات هیدروکسیآپاتیت و بیوگلاس در داربستهای استخوانی باعث استخوانسازی سریعتر و بهبود پیوند بین داربست و بافت میزبان میشوند. همچنین، نانوذرات نقره و اکسید روی علاوه بر خاصیت آنتیباکتریال، میتوانند از عفونت در محل ترمیم بافت جلوگیری کرده و محیطی ایمنتر برای رشد سلولها فراهم آورند.
نانوفناوری در ترمیم بافت استخوان
ترمیم شکستگیهای شدید یا نقصهای بزرگ استخوانی از جمله حوزههایی است که بهشدت از نانو بهرهمند شده است. استفاده از نانوسرامیکها مانند هیدروکسیآپاتیت و تریکلسیم فسفات به همراه داربستهای پلیمری موجب افزایش استحکام مکانیکی، افزایش زیستسازگاری و بهبود اتصال استخوان جدید با داربست میشود. تحقیقات نشان داده است که استفاده از داربستهای نانوالیاف حاوی نانوذرات زیستفعال میتواند رشد سلولهای استئوبلاست را به شکل چشمگیری تسریع کند.
نانوفناوری در بازسازی بافت عصبی
بازسازی بافتهای عصبی یکی از سختترین چالشهای مهندسی بافت است. نانوذرات و نانوداربستها با قابلیت هدایت الکتریکی و انتقال سیگنالهای عصبی نقش مهمی در ترمیم آسیبهای نخاعی و بازسازی اعصاب محیطی دارند. برای مثال، استفاده از نانوالیاف رسانا مانند پلیآنیلین و پلیپیرول موجب بهبود هدایت الکتریکی در داربستها و افزایش رشد آکسونهای عصبی میشود. علاوه بر این، بارگذاری فاکتورهای رشد عصبی (NGF، BDNF) در نانوذرات زیستتخریبپذیر سبب رهایش کنترلشده این عوامل و تقویت فرآیند بازسازی عصبی میشود.
نانوفناوری در ترمیم پوست و زخم
در زمینه ترمیم پوست و درمان زخمها، نانوذرات به دلیل ویژگیهای ضدباکتریایی، آنتیاکسیدانی و توانایی کنترل رهایش داروها بسیار مؤثر هستند. نانوکامپوزیتهای حاوی نقره، کیتوسان و پلیمرهای زیستتخریبپذیر در پانسمانهای زخم استفاده میشوند و ضمن جلوگیری از عفونت، محیطی مرطوب و مناسب برای بازسازی سلولهای پوستی فراهم میآورند. همچنین، نانوالیاف تولیدشده به روش الکتروریسی میتوانند بهعنوان داربست برای کشت سلولهای فیبروبلاست عمل کرده و به تسریع فرآیند بازسازی پوست کمک کنند.
نانوفناوری در مهندسی غضروف
غضروف به دلیل نداشتن رگهای خونی، توانایی کمی در ترمیم خود دارد. استفاده از داربستهای نانوالیاف حاوی نانوذرات زیستفعال باعث افزایش چسبندگی و تکثیر سلولهای غضروفی میشود. علاوه بر این، استفاده از هیدروژلهای نانوساختار بهعنوان داربستهای سهبعدی، محیطی مشابه با ECM غضروف ایجاد میکند و به شکل چشمگیری در بازسازی بافت غضروف مؤثر است.
نانوفناوری در قلب و عروق
ترمیم بافت قلبی پس از سکته قلبی یکی دیگر از زمینههای پرکاربرد نانو در مهندسی بافت است. استفاده از داربستهای نانوالیافی که قابلیت رسانایی الکتریکی دارند، به همگامسازی انقباضات سلولهای قلبی کمک میکند. همچنین، نانوذرات حاوی فاکتورهای رشد مانند VEGF میتوانند آنژیوژنز یا رگزایی را تحریک کرده و جریان خون در بافت قلبی آسیبدیده را بهبود بخشند.
چالشها و آینده نانو در مهندسی بافت
با وجود پیشرفتهای چشمگیر، چالشهایی همچون ایمنی بلندمدت نانومواد، کنترل دقیق رهایش داروها و فاکتورهای رشد، و مشکلات مربوط به مقیاسپذیری تولید همچنان باقی است. با این حال، آینده نانوفناوری در مهندسی بافت بسیار امیدوارکننده است. ترکیب نانو فناوری با سلولهای بنیادی و استفاده از چاپ سهبعدی نانو داربستها چشمانداز جدیدی برای بازسازی ارگانهای پیچیده انسانی ایجاد کرده است.
ایمنی و سمیت نانو مواد در پزشکی
یکی از مهمترین چالشهایی که در مسیر توسعه و استفاده گسترده از نانو فناوری در پزشکی وجود دارد، مسئله ایمنی و سمیت نانو مواد است. هرچند نانوذرات و نانوساختارها مزایای زیادی در تشخیص، درمان و پیشگیری از بیماریها دارند، اما اندازه کوچک و ویژگیهای خاص فیزیکوشیمیایی آنها میتواند باعث بروز اثرات ناخواسته در بدن شود. بنابراین، بررسی دقیق ایمنی، زیستسازگاری و سمیت این مواد برای تضمین موفقیت بالینی و جلوگیری از بروز عوارض جانبی بسیار حیاتی است.
ویژگیهای فیزیکوشیمیایی و نقش آنها در سمیت
نانوذرات به دلیل اندازه بسیار کوچک، نسبت سطح به حجم بالا و واکنشپذیری شیمیایی خاص رفتار متفاوتی نسبت به مواد در مقیاس ماکرو دارند. این ویژگیها باعث میشود:
-
توانایی نفوذ به غشاء سلولی و حتی عبور از سدهای بیولوژیکی مانند سد خونی-مغزی افزایش یابد.
-
تمایل به تجمع در اندامهای خاص مانند کبد، طحال، ریهها و کلیهها بیشتر شود.
-
امکان ایجاد استرس اکسیداتیو، التهاب و آسیب به DNA وجود داشته باشد.
بهعنوان مثال، نانوذرات فلزی مانند نقره، طلا و اکسید تیتانیوم بسته به اندازه، شکل و بار سطحی میتوانند اثرات متفاوتی بر سلولها داشته باشند. برخی از آنها خواص ضدباکتریایی یا ضدسرطانی دارند، اما در غلظتهای بالا یا در شرایط خاص ممکن است به غشاء سلولی آسیب برسانند و حتی مرگ سلولی القا کنند.
مسیرهای ورود نانو مواد به بدن
نانو مواد میتوانند از طریق مسیرهای مختلف وارد بدن شوند:
-
تزریق مستقیم در جریان خون یا بافتها (در درمانهای دارویی و ژندرمانی).
-
استنشاق (در محیطهای آلوده یا کاربردهای نانو داروهای استنشاقی).
-
بلع (در داروهای خوراکی یا نانوکپسولهای حامل مواد مغذی).
-
تماس پوستی (در کرمها، پمادها و لوازم آرایشی مبتنی بر نانو).
هر یک از این مسیرها میتواند اثرات متفاوتی بر نحوه توزیع، متابولیسم و دفع نانوذرات در بدن داشته باشد.
سمیت سلولی و مولکولی
یکی از مهمترین نگرانیها در استفاده از نانو مواد، سمیت سلولی است. برخی از اثرات نامطلوب شامل:
-
استرس اکسیداتیو: تولید گونههای فعال اکسیژن (ROS) که میتواند باعث آسیب به لیپیدها، پروتئینها و DNA شود.
-
التهاب: فعالسازی سیستم ایمنی و ترشح سایتوکاینها که در طولانیمدت میتواند منجر به بیماریهای مزمن شود.
-
مرگ سلولی: القای آپوپتوز یا نکروز در سلولها به دلیل اختلال در عملکرد میتوکندری یا آسیب DNA.
-
جهشزایی و سرطانزایی بالقوه: در صورت تخریب ساختار ژنتیکی سلولها.
سمیت در سطح اندامها
-
کبد و کلیه: به دلیل نقش در متابولیسم و دفع مواد، بیشتر در معرض تجمع نانوذرات قرار دارند. آسیب به این اندامها میتواند عملکرد حیاتی بدن را مختل کند.
-
ریهها: استنشاق نانوذرات ممکن است منجر به التهاب مزمن، فیبروز یا حتی سرطان ریه شود.
-
سیستم عصبی مرکزی: برخی نانوذرات قادر به عبور از سد خونی-مغزی هستند و ممکن است اثرات مخربی بر عملکرد عصبی داشته باشند.
-
سیستم ایمنی: نانوذرات میتوانند پاسخهای ایمنی غیرمنتظرهای ایجاد کنند؛ از جمله واکنشهای آلرژیک یا سرکوب ایمنی.
روشهای ارزیابی ایمنی و سمیت
برای اطمینان از استفاده ایمن نانو مواد در پزشکی، روشهای متعددی برای ارزیابی ایمنی آنها به کار میرود:
-
آزمایشهای درونکشتگاهی :(in vitro) بررسی اثرات نانوذرات بر سلولهای انسانی و حیوانی در محیط آزمایشگاهی.
-
آزمایشهای درونتنی :(in vivo) بررسی رفتار نانوذرات در بدن حیوانات مدل و ارزیابی سمیت در اندامها.
-
آزمایشهای بالینی: بررسی ایمنی و کارایی نانو مواد در بیماران انسانی تحت شرایط کنترلشده.
-
مدلسازی و شبیهسازی کامپیوتری: پیشبینی رفتار نانوذرات بر اساس ویژگیهای فیزیکوشیمیایی آنها.
راهکارهای کاهش سمیت
برای کاهش خطرات ناشی از نانو مواد در پزشکی، راهکارهای مختلفی در حال توسعه است:
-
سطحپوشانی :(Surface modification) تغییر سطح نانوذرات با پلیمرها یا مولکولهای زیستسازگار برای کاهش سمیت.
-
استفاده از نانو مواد زیستتخریبپذیر: طراحی نانوذراتی که پس از انجام عملکرد خود، به مواد غیرسمی تجزیه شوند.
-
تعیین دوز بهینه: استفاده از غلظتهای کنترلشده که اثربخشی درمانی را حفظ کرده و در عین حال سمیت را به حداقل برساند.
-
ایجاد سیستمهای هدفمند: رساندن نانوذرات به بافت یا سلول هدف برای جلوگیری از آسیب به سلولهای سالم.
چالشها و آیندهپژوهی
با وجود پیشرفتهای چشمگیر، هنوز شکافهای علمی و فناورانه زیادی در درک ایمنی نانو مواد وجود دارد. استانداردهای جهانی مشخص و یکپارچه برای ارزیابی سمیت نانوذرات هنوز به طور کامل تدوین نشدهاند. علاوه بر این، تنوع بسیار زیاد در نوع نانوذرات، ابعاد، اشکال و پوششهای سطحی باعث میشود پیشبینی رفتار آنها در بدن دشوار باشد.
در آینده، تمرکز پژوهشها بر توسعه پروتکلهای استاندارد ارزیابی ایمنی، ایجاد بانکهای اطلاعاتی جامع از سمیت نانو مواد، و طراحی نانوذرات هوشمند با حداقل اثرات جانبی خواهد بود. تنها در این صورت میتوان به کاربرد گسترده و ایمن نانو فناوری در پزشکی امیدوار بود.
چالشها و محدودیتهای استفاده از نانوتکنولوژی در پزشکی
با وجود دستاوردهای قابل توجه نانوتکنولوژی در حوزه پزشکی، هنوز مسیر استفاده گسترده و بالینی از این فناوری با چالشها و محدودیتهای متعددی روبهرو است. این چالشها نه تنها به جنبههای فنی و علمی مربوط میشوند، بلکه شامل مسائل اقتصادی، اخلاقی، حقوقی و اجتماعی نیز هستند. در ادامه مهمترین موانع و محدودیتهای موجود در این مسیر مورد بررسی قرار میگیرند.
چالشهای علمی و فنی
یکی از اصلیترین مشکلات، پیچیدگیهای زیستی و شیمیایی بدن انسان است. طراحی نانوذرات یا نانوساختارهایی که بتوانند به طور دقیق با سلولها، بافتها و اندامها تعامل داشته باشند، همچنان دشوار است. بسیاری از نانوذرات در شرایط آزمایشگاهی کارایی مناسبی نشان میدهند، اما در محیط پیچیده بدن، تحت تأثیر سیستم ایمنی، آنزیمها و تغییرات pH کارایی آنها کاهش مییابد. علاوه بر این، مشکل عبور از سدهای بیولوژیکی مانند سد خونی-مغزی همچنان یک مانع جدی محسوب میشود.
ایمنی و سمیت نانومواد
یکی از نگرانیهای عمده در استفاده از نانوتکنولوژی، احتمال بروز سمیت و اثرات ناخواسته در بدن است. نانومواد به دلیل اندازه کوچک خود، قادرند وارد اندامها و حتی هسته سلول شوند. این ویژگی در عین اینکه فرصتی برای درمانهای هدفمند فراهم میکند، میتواند به بروز واکنشهای ایمنی، جهشهای ژنتیکی یا آسیبهای سلولی منجر شود. همچنین اثرات طولانیمدت تجمع نانوذرات در بافتهای حساس مانند کبد، کلیه و مغز هنوز به طور کامل شناخته نشده است.
چالشهای اقتصادی و هزینههای بالا
توسعه و تولید نانوداروها یا تجهیزات مبتنی بر نانو، نیازمند زیرساختهای پیشرفته، تجهیزات گرانقیمت و دانش فنی بالا است. این موضوع باعث میشود هزینه نهایی درمان برای بیماران افزایش یابد. در بسیاری از کشورها، بهویژه کشورهای در حال توسعه، هزینه بالای تولید و عدم دسترسی به فناوریهای پیشرفته مانعی برای تجاریسازی و استفاده گسترده از نانوتکنولوژی محسوب میشود.
موانع قانونی و نظارتی
یکی دیگر از محدودیتها، نبود قوانین و استانداردهای مشخص برای ارزیابی و تأیید نانوداروها و محصولات پزشکی نانویی است. بسیاری از کشورها هنوز دستورالعملهای روشنی در زمینه ایمنی، کیفیت و کارایی نانومواد در پزشکی ندارند. این موضوع روند ورود محصولات نانویی به بازار را کند میکند و باعث عدم اعتماد عمومی و حرفهای به این فناوری میشود.
چالشهای اخلاقی و اجتماعی
مسائل اخلاقی در زمینه دستکاریهای ژنتیکی، استفاده از نانوروباتها یا سیستمهای هوشمند در بدن انسان از جمله مباحث بحثبرانگیز هستند. برخی نگرانیها شامل امکان سوءاستفاده از نانوتکنولوژی در حوزههای نظامی یا امنیتی، نقض حریم خصوصی بیماران با استفاده از نانوحسگرها و دسترسی نابرابر به این فناوری در میان جوامع مختلف است.
پایداری زیستمحیطی
یکی از دغدغههای مهم، اثر نانومواد بر محیط زیست است. بسیاری از نانوذرات پس از استفاده در بدن یا در مراحل تولید و دفع به محیط وارد میشوند و میتوانند چرخههای زیستی طبیعی را مختل کنند. آلودگیهای ناشی از نانومواد در خاک و آب میتواند اثرات بلندمدتی بر اکوسیستمها و سلامت انسانها داشته باشد.
چالشهای مربوط به مقیاسپذیری
هرچند بسیاری از پژوهشها در مقیاس آزمایشگاهی نتایج موفقی ارائه دادهاند، اما انتقال فناوری از آزمایشگاه به مقیاس صنعتی همچنان دشوار است. تولید نانومواد با کیفیت یکنواخت، در حجم زیاد و با هزینه مناسب یکی از موانع اصلی برای ورود گسترده به عرصه پزشکی است.
عدم قطعیت در پذیرش عمومی
بخش دیگری از محدودیتها به نگرش بیماران و جامعه پزشکی مربوط میشود. بسیاری از افراد هنوز نسبت به ایمنی و کارایی نانوداروها تردید دارند. این موضوع میتواند روند پذیرش و استفاده از درمانهای نوین مبتنی بر نانوتکنولوژی را با تأخیر مواجه کند.
در مجموع، میتوان گفت که نانوتکنولوژی اگرچه ظرفیت بسیار بالایی برای تحول در پزشکی دارد، اما برای تحقق کامل این پتانسیل باید چالشهای علمی، ایمنی، اقتصادی، قانونی و اخلاقی آن برطرف شوند. همکاری چندرشتهای بین پزشکان، دانشمندان، مهندسان، قانونگذاران و اقتصاددانان میتواند راهکارهای مؤثری برای غلبه بر این موانع ارائه دهد و مسیر آینده پزشکی نانویی را هموارتر سازد.
آینده نانو تکنولوژی در پزشکی: چشماندازها و نوآوریها
نانو تکنولوژی به عنوان یکی از انقلابیترین حوزههای علمی، آیندهای شگفتانگیز را برای پزشکی رقم خواهد زد. ترکیب دانش در مقیاس نانو با نیازهای پیچیده پزشکی میتواند موجب تحول در روشهای تشخیص، درمان، پیشگیری و حتی بازسازی بافتهای انسانی شود. در این بخش، به بررسی چشماندازهای نوآوریهای آینده و تأثیرات بالقوه آنها بر حوزه سلامت میپردازیم.
نانوروباتهای پزشکی
یکی از جذابترین چشماندازهای آینده، توسعه نانوروباتها یا نانوماشینهای هوشمند است. این روباتهای در مقیاس نانو میتوانند بهطور هدفمند وارد بدن شده و وظایفی چون تشخیص سریع بیماریها، رساندن دارو به سلولهای خاص، از بین بردن تومورهای سرطانی، و پاکسازی عروق از پلاکهای چربی را برعهده گیرند. پژوهشهای اخیر نشان میدهد که نانوروباتها با قابلیت کنترل مغناطیسی یا بیوشیمیایی، میتوانند در آینده به جای جراحیهای تهاجمی استفاده شوند.
پزشکی شخصی و درمانهای هوشمند
آینده پزشکی به سمت درمانهای شخصیسازیشده حرکت میکند؛ جایی که نانوذرات و نانوسنسورها قادرند با تحلیل دقیق ژنوم، پروتئوم و متابولوم افراد، دارو و دوز موردنیاز را بهطور اختصاصی برای هر بیمار طراحی کنند. این فناوری به کاهش عوارض جانبی و افزایش کارایی درمان منجر خواهد شد. به عنوان مثال، نانوذرات قابل برنامهریزی میتوانند در بدن آزادسازی دارو را با توجه به شرایط متابولیک بیمار تنظیم کنند.
تشخیصهای فوقسریع و غیرتهاجمی
نانوحسگرهای زیستی نسل آینده بهطور چشمگیری حساسیت و دقت در تشخیص بیماریها را افزایش خواهند داد. این حسگرها قادرند بیماریهایی مانند سرطان، آلزایمر، دیابت و عفونتهای ویروسی را در مراحل بسیار ابتدایی شناسایی کنند، حتی قبل از آنکه علائم بالینی ظاهر شوند. علاوه بر این، نانوتراشهها و سیستمهای مبتنی بر میکروفلوئیدیک امکان انجام آزمایشهای پیچیده را تنها با یک قطره خون و در مدت چند دقیقه فراهم خواهند کرد.
بازسازی بافتها و اندامهای مصنوعی
در آینده، ترکیب نانوتکنولوژی با مهندسی بافت و پزشکی بازساختی میتواند به تولید اندامهای مصنوعی کاملاً مشابه اندامهای طبیعی انسان منجر شود. داربستهای نانوساختار نه تنها رشد سلولها را تسهیل میکنند، بلکه میتوانند سیگنالهای زیستی لازم برای بازسازی کامل بافتها را فراهم آورند. این موضوع چشمانداز درمان نارساییهای اندامی، سوختگیهای شدید و آسیبهای نخاعی را متحول خواهد کرد.
واکسنها و داروهای نسل آینده
نانو تکنولوژی نقشی کلیدی در تولید واکسنهای هوشمند و داروهای نسل آینده ایفا خواهد کرد. با استفاده از نانوذرات حامل، واکسنها قادر خواهند بود پاسخ ایمنی قویتر، سریعتر و پایدارتر ایجاد کنند. همچنین نانوفرمولاسیونها امکان طراحی داروهایی با قدرت نفوذ بالاتر به سد خونی–مغزی و با توانایی غلبه بر مقاومت دارویی را فراهم خواهند ساخت.
ادغام با هوش مصنوعی و اینترنت اشیا پزشکی
آینده پزشکی نانو بدون توجه به هوش مصنوعی (AI) و اینترنت اشیای پزشکی (IoMT) کامل نخواهد بود. دادههای جمعآوریشده از نانوسنسورها و نانوتراشهها میتواند با الگوریتمهای یادگیری ماشین تحلیل شود و پزشکان را در تصمیمگیریهای سریعتر و دقیقتر یاری دهد. به علاوه، اتصال این سیستمها به شبکههای پزشکی از راه دور، امکان پایش لحظهای بیماران و مداخله فوری در شرایط بحرانی را فراهم میکند.
چالشهای اخلاقی و اجتماعی در آینده
با وجود تمام این پیشرفتها، چالشهای اخلاقی، اجتماعی و قانونی نیز اجتنابناپذیر خواهد بود. مسائلی مانند حفظ حریم خصوصی دادههای زیستی، عدالت در دسترسی به درمانهای پیشرفته، و مدیریت اثرات پیشبینینشده نانومواد، در آینده اهمیت بیشتری پیدا خواهند کرد. در نتیجه، توسعه نانوپزشکی نیازمند همکاری میان دانشمندان، سیاستگذاران، پزشکان و فیلسوفان اخلاق خواهد بود.
جمعبندی چشمانداز آینده
به طور کلی، آینده نانو تکنولوژی در پزشکی ترکیبی از نوآوریهای فناورانه، درمانهای شخصیسازیشده، ابزارهای تشخیصی فوقحساس، و سیستمهای بازساختی پیشرفته خواهد بود. این فناوری میتواند مفهوم پزشکی را از یک درمان واکنشی به یک سیستم پیشبینانه، پیشگیرانه و دقیق تغییر دهد. اگرچه مسیر توسعه آن با چالشهایی همراه است، اما فرصتهای بیسابقهای برای ارتقای کیفیت زندگی بشر و افزایش طول عمر سالم فراهم خواهد کرد.
نتیجهگیری جامع
نانوتکنولوژی در پزشکی نه تنها یک دستاورد علمی و فناورانه است، بلکه تحولی بنیادین در نحوه تشخیص، درمان و پیشگیری بیماریها ایجاد کرده است. در طول این مقاله، با بررسی کامل اصول پایهای، کاربردها و محدودیتهای نانو تکنولوژی در حوزههای مختلف پزشکی، مشخص شد که این فناوری میتواند انقلابی در درمانهای هدفمند، دارورسانی، تشخیص زودهنگام، درمان سرطان، بیماریهای قلبی-عروقی، عصبی و عفونی و همچنین مهندسی و ترمیم بافتها ایجاد کند.
مزایای نانو تکنولوژی در پزشکی شامل توانایی هدفگیری دقیق سلولها و بافتها، کاهش عوارض جانبی داروها، تشخیص سریع و فوقحساس بیماریها، بازسازی بافتها و تولید درمانهای شخصیسازیشده است. سیستمهای نانو قادرند با عبور از موانع زیستی و تعامل هوشمندانه با سلولها، کارایی درمانی را به میزان قابل توجهی افزایش دهند.
با این حال، مسیر توسعه نانوپزشکی با چالشها و محدودیتهای متعددی همراه است. ایمنی و سمیت نانوذرات، مشکلات اقتصادی و هزینه تولید، نبود استانداردهای قانونی یکپارچه، مسائل اخلاقی و اجتماعی، و نگرانیهای زیستمحیطی، از جمله محدودیتهایی هستند که باید پیش از ورود گسترده این فناوری به بالین پزشکی برطرف شوند. ارزیابیهای دقیق درونکشتگاهی، درونتنی و بالینی، توسعه نانوذرات زیستتخریبپذیر و طراحی سیستمهای هدفمند، میتوانند این چالشها را کاهش دهند.
چشمانداز آینده نانو تکنولوژی در پزشکی بسیار روشن و امیدوارکننده است. نانوروباتها، نانوسنسورها، داروهای نسل جدید، واکسنهای هوشمند و سیستمهای پزشکی متصل به هوش مصنوعی، همگی نوید یک پزشکی پیشبینانه، شخصیسازیشده و دقیق را میدهند. ترکیب نانو تکنولوژی با مهندسی بافت و پزشکی بازساختی نیز امکان تولید اندامهای مصنوعی و بازسازی بافتهای آسیبدیده را فراهم میکند.
در نهایت، موفقیت نانوپزشکی نیازمند همکاری چندرشتهای بین دانشمندان، پزشکان، مهندسان، قانونگذاران و جامعه است تا ضمن بهرهگیری از مزایای بینظیر نانو، اثرات جانبی و چالشهای اخلاقی و اجتماعی آن نیز مدیریت شوند. اگر این مسیر به درستی طی شود، نانو تکنولوژی میتواند پزشکی مدرن را از درمانهای واکنشی به سیستمی پیشگیرانه، دقیق و هوشمندانه تبدیل کند و کیفیت زندگی بشر را به طرز چشمگیری ارتقا دهد.