نانو در دارورسانی هدفمند
مقدمه
در دنیای مدرن پزشکی، دارورسانی هدفمند یکی از چالشهای اصلی در توسعه درمانهای مؤثر و کمعوارض به شمار میرود. با وجود پیشرفتهای چشمگیر در شیمی دارویی و فناوریهای درمانی، بسیاری از داروها همچنان با مشکلاتی مانند تجزیه سریع در بدن، توزیع نامناسب در بافتها، عوارض جانبی سیستمیک و مقاومت دارویی مواجه هستند. این محدودیتها، نیاز به رویکردهای نوآورانه در طراحی و ارائه داروها را آشکار کردهاند. در این میان، نانوتکنولوژی به عنوان یک ابزار تحولآفرین در پزشکی مطرح شده است، که با ویژگیهای منحصر به فرد خود، امکان تحویل دارو به محل دقیق هدف را فراهم میکند و میتواند کیفیت درمان را به طرز چشمگیری افزایش دهد.
نانوذرات و نانوساختارها به دلیل اندازه بسیار کوچک (در محدوده نانومتر)، سطح ویژه بالا و قابلیت تغییرپذیری سطحی، توانایی ورود به سلولها و بافتها را دارند. این ویژگیها امکان توسعه داروهای هدفمند با حداقل عوارض جانبی را فراهم میکنند. در واقع، نانومواد میتوانند به عنوان حاملهای هوشمند عمل کرده و داروها را به سلولها، بافتها یا اندامهای خاص هدایت کنند. این امر به ویژه در درمان بیماریهایی مانند سرطان، بیماریهای عصبی، بیماریهای کبدی و عفونتهای مقاوم به دارو اهمیت فوقالعادهای دارد.
یکی از مزیتهای کلیدی دارورسانی هدفمند با نانو، افزایش سایر قابلیتهای درمانی داروها است. داروهایی که با روشهای سنتی وارد بدن میشوند، معمولاً بخشی از اثر خود را قبل از رسیدن به محل هدف از دست میدهند و ممکن است بر بافتهای سالم نیز اثرات مخرب داشته باشند. نانوذرات میتوانند با طراحی سطحی خاص، دارو را به محل مورد نظر هدایت کنند و از آزادسازی زودرس آن جلوگیری کنند. این قابلیت باعث میشود که دوزهای پایینتر داروها اثر درمانی مشابه یا حتی بهتر داشته باشند و در نتیجه عوارض جانبی کاهش یابد.
از سوی دیگر، نانوتکنولوژی نه تنها به عنوان یک ابزار دارورسانی هدفمند، بلکه به عنوان یک فناوری چندمنظوره در پزشکی مطرح شده است. نانوذرات میتوانند همزمان به عنوان حامل دارو، عامل تصویربرداری و حتی ابزار تشخیصی مورد استفاده قرار گیرند. این ویژگی باعث ایجاد رویکردهای تشخیص و درمان همزمان (Theranostics) شده و امکان پایش دقیق فرآیند درمان و اصلاح آن در زمان واقعی را فراهم میکند.
در نهایت، اهمیت استفاده از نانوتکنولوژی در دارورسانی هدفمند از دو جنبه قابل بررسی است: افزایش کارایی درمان و کاهش عوارض جانبی داروها، و توانایی ارائه درمانهای نوین و ترکیبی که با استفاده از داروهای سنتی و مدرن، پاسخهای درمانی بهینهتری ایجاد میکنند. با توجه به رشد روزافزون دانش نانو و پیشرفتهای صنعتی و بالینی، نانو در دارورسانی هدفمند به یکی از محورهای اصلی تحقیقات پزشکی و دارویی در جهان تبدیل شده است و چشماندازهای وسیعی برای آینده درمان بیماریهای پیچیده ارائه میدهد.
در این مقاله، تلاش شده است تا مرور جامع و کاملی بر مباحث کلیدی نانو در دارورسانی هدفمند ارائه شود، شامل انواع نانوساختارها، مکانیزمهای هدفمندسازی، کاربردها در بافتها و اندامهای مختلف، ترکیب با داروهای سنتی، چالشها، مزایا و نوآوریهای آینده. هدف این است که خواننده، چه متخصص و چه علاقهمند به علوم پزشکی، تصویری کامل از این حوزه پیشرفته و تحولآفرین به دست آورد.
درک نانو در دارورسانی هدفمند
برای فهم کامل نقش نانو در دارورسانی هدفمند، ابتدا لازم است مفاهیم پایهای نانوذرات و نانوساختارها، مکانیزمهای هدفمندسازی دارو و تفاوت آن با روشهای سنتی دارورسانی تشریح شود.
تعریف نانوذرات و نانوساختارها
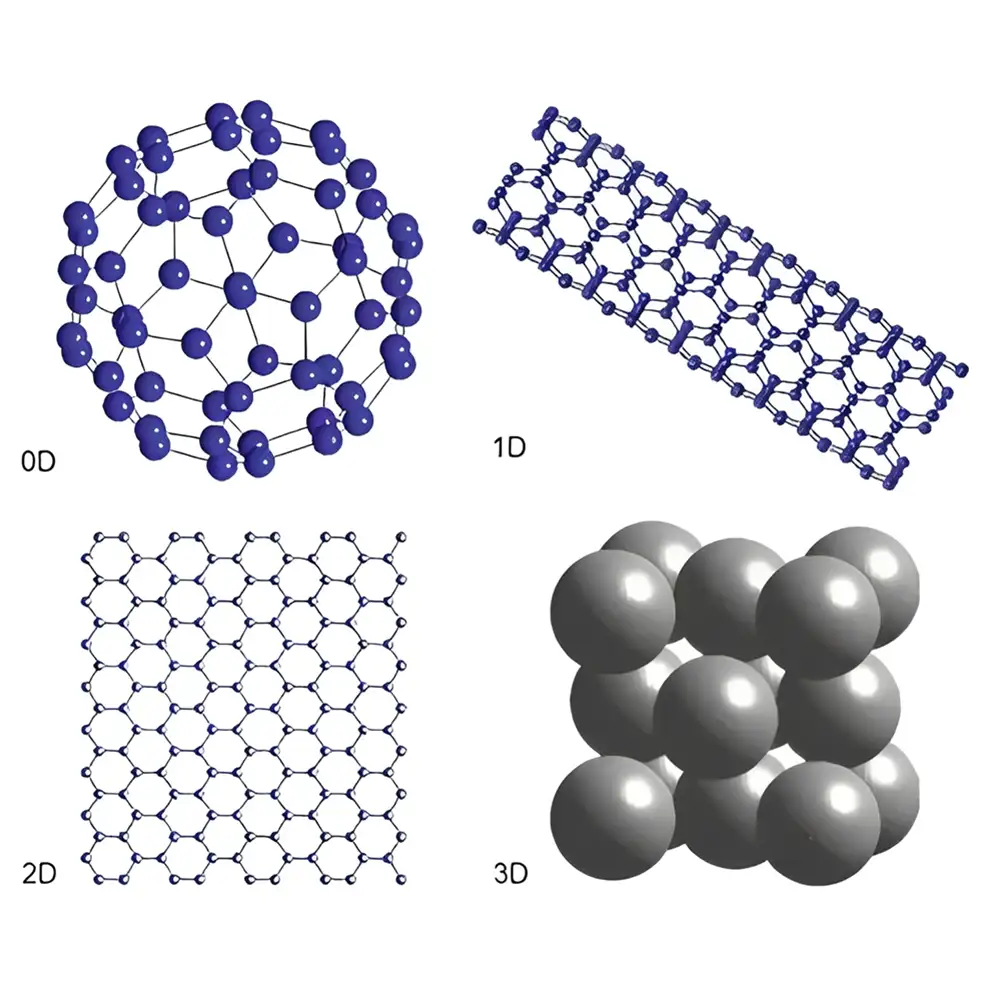
نانوساختارها، موادی هستند که ابعاد آنها در مقیاس نانومتر (۱ تا ۱۰۰ نانومتر) قرار دارد. در این ابعاد، خواص فیزیکی و شیمیایی مواد تغییر میکند و ویژگیهای منحصر به فردی مانند سطح ویژه بالا، قابلیت نفوذپذیری بالا، و تعاملات مولکولی دقیق با سلولها و بافتها ایجاد میشود. این ویژگیها باعث میشود که نانوذرات بتوانند به عنوان حاملهای هوشمند دارو عمل کنند و داروها را با دقت بالا به سلولها یا بافتهای هدف برسانند.
نانوساختارها میتوانند ذرات جامد، میسلها، لیپوزومها، نانوذرات پلیمری، نانوذرات مغناطیسی، نانولولههای کربنی و سیستمهای مبتنی بر DNA و RNA باشند. هر یک از این سیستمها ویژگیها و کاربردهای خاص خود را دارند که بسته به نوع دارو و هدف درمانی انتخاب میشوند. به عنوان مثال، لیپوزومها و نانوذرات لیپیدی برای داروهای آبدوست و محلول در آب مناسب هستند، در حالی که نانوذرات پلیمری قابلیت رهایش کنترلشده دارو را بهبود میبخشند.
مکانیزمهای دارورسانی هدفمند
در دارورسانی سنتی، داروها معمولاً به صورت سیستمیک وارد بدن میشوند و تنها بخش کمی از آنها به محل هدف میرسد. این روش باعث عوارض جانبی، سمیت در بافتهای سالم و کاهش کارایی درمان میشود. در مقابل، دارورسانی هدفمند با نانوذرات امکان انتقال دقیق دارو به سلولها یا بافتهای مورد نظر را فراهم میکند و به دو روش اصلی انجام میشود:
-
هدفمندسازی غیرفعال :(Passive Targeting) این روش بر اساس ویژگیهای فیزیکی و شیمیایی بافتها و محیط سلولی عمل میکند. برای مثال، تومورها دارای رگهای خونی نفوذپذیر و سیستم لنفاوی ضعیف هستند که باعث میشود نانوذرات به طور طبیعی در این نواحی تجمع پیدا کنند. این پدیده به عنوان اثر نفوذپذیری و ماندگاری طولانی (EPR Effect) شناخته میشود.
-
هدفمندسازی فعال :(Active Targeting) در این روش، نانوذرات سطحی پوشش داده شده با لیگاندها، آنتیبادیها، پپتیدها یا مولکولهای شناساییکننده سلولهای خاص دارند. این پوشش باعث میشود که نانوذرات تنها به سلولهای هدف متصل شوند و دارو را در محل مورد نظر آزاد کنند. هدفمندسازی فعال به خصوص در درمان سرطان، بیماریهای عصبی و عفونتهای مقاوم به دارو اهمیت دارد.
تفاوت بین دارورسانی غیرهدفمند و هدفمند
در دارورسانی غیرهدفمند، داروها به طور گسترده در بدن پخش میشوند و بخش زیادی از آنها به بافتهای سالم میرسند، که میتواند منجر به سمیت سیستمیک و عوارض جانبی شدید شود. در دارورسانی هدفمند، نانوذرات دارو را به صورت کنترلشده و دقیق به محل هدف منتقل میکنند و رهایش دارو تنها در محیط مورد نظر اتفاق میافتد. این روش باعث افزایش کارایی دارو، کاهش دوز مصرفی و کاهش خطرات جانبی میشود.
ویژگیهای کلیدی نانوذرات در دارورسانی هدفمند
-
اندازه کوچک: توانایی عبور از غشاهای سلولی و ورود به بافتها
-
سطح ویژه بالا: امکان اتصال داروها و مولکولهای شناساییکننده
-
پایداری شیمیایی و زیستی: محافظت از داروها در برابر تجزیه و اکسیداسیون
-
قابلیت تغییرپذیری سطحی: امکان هدفمندسازی فعال و افزایش زیستسازگاری
-
توانایی آزادسازی کنترلشده: رهایش تدریجی و زمانبندیشده دارو
مزایای استفاده از نانو در دارورسانی هدفمند
-
افزایش دقت و اثربخشی درمان
-
کاهش عوارض جانبی و سمیت داروها
-
امکان رهایش دارو در زمان و محل مورد نظر
-
قابلیت ترکیب درمان و تشخیص (Theranostics)
-
توانایی غلبه بر مقاومت دارویی و حملات میکروبی مقاوم
با درک کامل این مفاهیم، محققان و پزشکان میتوانند استراتژیهای طراحی نانوذرات را برای درمان بیماریهای پیچیده بهینه کنند و داروهای هدفمند با اثرات درمانی بالا و عوارض جانبی کم ارائه دهند. این بخش، پایهای علمی برای مطالعه انواع نانوساختارها، مکانیزمهای هدفمندسازی و کاربردهای درمانی آنها فراهم میکند.
انواع نانوساختارها در دارورسانی هدفمند
در دارورسانی هدفمند، انتخاب نوع نانوذرات اهمیت بسیار زیادی دارد زیرا ویژگیهای فیزیکی و شیمیایی هر نانوساختار میتواند تاثیر مستقیم بر اثربخشی، زیستسازگاری و ایمنی داروها داشته باشد. نانوساختارها بر اساس مواد تشکیلدهنده، شکل، سطح و خواص عملکردی به چند دسته اصلی تقسیم میشوند که هر کدام مزایا و محدودیتهای خاص خود را دارند.
نانوذرات لیپیدی
نانوذرات لیپیدی شامل لیپوزومها، نانوذرات لیپیدی جامد (SLN) و نانوذرات لیپیدی اصلاحشده هستند. این سیستمها به دلیل سازگاری بالای بیولوژیکی و قابلیت بارگذاری هم داروهای آبدوست و هم داروهای چربیدوست، در دارورسانی هدفمند بسیار مورد توجه قرار گرفتهاند.
-
لیپوزومها: ساختار لیپوزومها شامل یک یا چند لایه فسفولیپیدی است که دارو را در هسته آبی یا میان لایه لیپیدی نگه میدارد. این سیستمها محافظت از دارو در برابر تجزیه، کاهش عوارض جانبی و قابلیت هدفمندسازی فعال با لیگاندها یا آنتیبادیها را فراهم میکنند. لیپوزومها در درمان سرطان، بیماریهای عفونی و بیماریهای چشمی کاربرد دارند.
-
نانوذرات لیپیدی جامد (SLN): این ذرات ساختاری جامد دارند و به دلیل پایداری بالا و رهایش کنترلشده دارو، در درمانهای طولانیمدت و داروهای حساس به تجزیه استفاده میشوند.
نانوذرات پلیمری
نانوساختارهای پلیمری شامل نانوذرات طبیعی و مصنوعی، میسلهای پلیمری و نانوژلها هستند. این سیستمها به دلیل قابلیت کنترل دقیق رهایش دارو و اصلاح سطحی برای هدفمندسازی فعال، در دارورسانی به تومورها، مغز و بافتهای خاص بسیار مفیدند.
-
نانوژلها: این ساختارهای شبکهای آبدوست میتوانند داروهای محلول در آب و پروتئینها را حمل کنند و با پاسخ به محیط (pH، دما یا آنزیمها) دارو را آزاد کنند.
-
پلیمرهای مصنوعی: پلیلاکتیک اسید (PLA)، پلیگلایکولیک اسید (PGA) و پلیلاکتیک-کو-گلیکولیک اسید (PLGA) از جمله پلیمرهای پرکاربرد هستند که زیستتخریبپذیر بوده و قابلیت هدفمندسازی دارند.
نانوساختارهای معدنی
نانوساختارهای معدنی شامل نانوذرات طلا، نقره، سیلیکا و آهن مغناطیسی هستند که به دلیل پایداری بالا، سطح ویژه گسترده و قابلیت اصلاح سطحی در دارورسانی هدفمند کاربرد دارند.
-
نانوذرات طلا: به دلیل زیستسازگاری بالا، خواص اپتیکی و توانایی اتصال لیگاندها، در درمان سرطان و تصویربرداری همزمان استفاده میشوند.
-
نانوذرات آهن مغناطیسی: این ذرات امکان هدایت مغناطیسی دارو به محل هدف را فراهم میکنند و در درمان تومور و دارورسانی به بافتهای خاص بسیار کارآمد هستند.
-
نانوذرات سیلیکا: به دلیل ساختار متخلخل، قابلیت بارگذاری حجم بالایی از دارو و رهایش کنترلشده را دارند.
نانوساختارهای کربنی
نانوساختارهای کربنی شامل نانولولههای کربنی، گرافن و فلورین هستند که به دلیل پایداری شیمیایی، سطح ویژه بالا و توانایی نفوذ به سلولها کاربردهای مهمی در دارورسانی هدفمند دارند. این سیستمها میتوانند داروها، ژنها و RNAهای کوچک را به سلولهای هدف منتقل کنند و در درمان سرطان، بیماریهای عصبی و عفونتها مفید باشند.
سیستمهای مبتنی بر DNA و RNA
یکی از پیشرفتهترین رویکردها در دارورسانی هدفمند، استفاده از نانوساختارهای DNA و RNA است. این سیستمها به دلیل توانایی برنامهریزی دقیق، طراحی مولکولی و اتصال دقیق به سلولهای هدف، در دارورسانی ژنی و درمانهای شخصیسازیشده اهمیت دارند. نمونههای معروف شامل DNA origami و نانوپارتیکلهای RNAi هستند که امکان تحویل دارو، ژن یا مولکولهای تنظیمکننده بیان ژن را فراهم میکنند.
ویژگیهای کلیدی هر نوع نانوساختار
-
لیپیدی: زیستسازگاری بالا، محافظت از دارو، هدفمندسازی فعال
-
پلیمری: رهایش کنترلشده، پاسخ به محیط، بارگذاری داروهای متنوع
-
معدنی: پایداری بالا، قابلیت تصویربرداری، هدایت مغناطیسی
-
کربنی: نفوذ به سلولها، سطح ویژه بالا، بارگذاری دارو و ژن
-
:DNA/RNAطراحی مولکولی دقیق، هدفمندسازی دقیق، درمانهای ژنی و شخصیسازیشده
مزایای استفاده از ترکیب نانوساختارها
در برخی تحقیقات، ترکیب چند نوع نانوساختار به صورت سیستمهای ترکیبی هیبریدی انجام میشود تا مزایای هر ساختار حفظ شود و محدودیتهای آن کاهش یابد. به عنوان مثال، ترکیب نانوذرات پلیمری و مغناطیسی میتواند هدفمندسازی فعال و هدایت مغناطیسی را همزمان فراهم کند، یا ترکیب لیپوزوم و DNA origami امکان رهایش کنترلشده دارو و درمان ژنی همزمان را ایجاد میکند.
با درک کامل انواع نانوساختارها و ویژگیهای منحصر به فرد هر یک، محققان و پزشکان میتوانند سیستم دارورسانی بهینه و هدفمند برای بیماریهای خاص طراحی کنند و اثربخشی درمان را به طور چشمگیری افزایش دهند. این بخش، پایه علمی و عملی لازم برای بررسی کاربردهای نانو در بافتها و اندامهای خاص فراهم میکند که در بخش بعدی مقاله به آن پرداخته خواهد شد.
مکانیزمهای هدفمندسازی
یکی از مهمترین ویژگیهای نانوذرات در دارورسانی هدفمند، توانایی آنها برای هدایت دقیق دارو به سلولها، بافتها یا اندامهای هدف است. مکانیزمهای هدفمندسازی به دو دسته اصلی تقسیم میشوند: هدفمندسازی غیرفعال (Passive Targeting) و هدفمندسازی فعال (Active Targeting)، هر یک با مکانیسمهای خاص خود عمل میکنند و در درمان بیماریهای مختلف نقش کلیدی دارند.
هدفمندسازی غیرفعال
در هدفمندسازی غیرفعال، نانوذرات بدون نیاز به اتصال لیگاند یا عامل شناسایی خاص، بر اساس ویژگیهای فیزیکی و بیولوژیکی بافت هدف به محل درمان هدایت میشوند.
-
اثر نفوذپذیری و ماندگاری طولانی :(EPR Effect) یکی از مشهورترین مکانیسمهای غیرفعال، تجمع نانوذرات در تومورها است. تومورها دارای رگهای خونی ناپایدار، نفوذپذیر و سیستم لنفاوی ناکارآمد هستند، که باعث میشود نانوذرات به طور طبیعی در این مناطق جمع شوند. این اثر باعث افزایش غلظت دارو در بافت تومور و کاهش توزیع در بافتهای سالم میشود.
-
ویژگیهای سطحی و اندازه نانوذرات: اندازه و سطح ذرات نقش مهمی در هدفمندسازی غیرفعال دارند. ذرات بسیار کوچک ممکن است از کلیهها دفع شوند، در حالی که ذرات بزرگتر ممکن است در سیستم رتیکولو-اندوتلیالی (RES) گرفتار شوند. انتخاب اندازه بهینه (۲۰–۲۰۰ نانومتر( باعث افزایش تجمع در بافت هدف و کاهش عوارض جانبی میشود.
-
بار سطحی و هیدروفیلیک/هیدروفوبیک بودن ذرات: نانوذرات هیدروفیلیک یا پوششدهی شده با پلیاتیلن گلیکول (PEGylation) میتوانند مدت زمان طولانیتری در گردش خون باقی بمانند و تجمع در محل هدف افزایش یابد.
هدفمندسازی فعال
هدفمندسازی فعال شامل استفاده از عوامل شناسایی مولکولی است که به صورت تخصصی به سلولها یا بافتهای هدف متصل میشوند. این روش به ویژه برای درمان سرطان، بیماریهای عصبی و عفونتهای مقاوم به دارو اهمیت دارد.
-
لیگاندها و آنتیبادیها: سطح نانوذرات میتواند با لیگاندها، آنتیبادیها یا پپتیدهای خاص سلولها پوشش داده شود. این پوشش باعث اتصال اختصاصی نانوذرات به گیرندههای موجود بر سطح سلولهای هدف میشود و رهایش دارو در محل دقیق صورت میگیرد. نمونهای از این کاربرد، اتصال نانوذرات به گیرنده HER2 در سلولهای سرطانی سینه است.
-
هدایت مغناطیسی: نانوذرات مغناطیسی میتوانند با استفاده از میدان مغناطیسی خارجی به محل هدف هدایت شوند. این روش به ویژه در درمان تومورها و دارورسانی به بافتهای عمیق بدن کاربرد دارد و امکان تمرکز بالای دارو را بدون افزایش دوز فراهم میکند.
-
حسگرهای محیطی و پاسخ به محرکها: برخی نانوذرات به شرایط محیطی خاص مانند pH پایین تومورها، آنزیمهای خاص یا دما پاسخ میدهند. این نانوذرات دارو را تنها در شرایط مشخص آزاد میکنند و باعث رهایش کنترلشده و هوشمند دارو میشوند.
ترکیب هدفمندسازی فعال و غیرفعال
در بسیاری از سیستمهای پیشرفته، نانوذرات از ترکیب هدفمندسازی غیرفعال و فعال بهره میبرند. برای مثال، نانوذرات پلیمری یا لیپیدی که PEGylation شدهاند، میتوانند از اثر EPR برای تجمع اولیه در تومور استفاده کنند و سپس با لیگاندهای سطحی، به سلولهای سرطانی متصل شوند و دارو را آزاد کنند. این رویکرد دقت و اثربخشی درمان را به حداکثر میرساند و عوارض جانبی را کاهش میدهد.
ویژگیهای کلیدی در طراحی نانوذرات هدفمند
-
انتخاب صحیح لیگاندها: لیگاندها باید اختصاصی و با گیرندههای هدف هماهنگ باشند تا اتصال غیرمطلوب به بافتهای سالم کاهش یابد.
-
بهینهسازی اندازه و بار سطحی: اندازه و سطح ذرات باید برای دستیابی به توزیع بهینه دارو و کاهش دفع سریع تنظیم شوند.
-
پایداری و زیستسازگاری: نانوذرات باید در طول گردش خون پایدار باشند و بافتهای سالم را تحریک یا تخریب نکنند.
-
رهایش کنترلشده: مکانیزمهای محیطی و حساس به محرک باید طراحی شوند تا دارو فقط در محل هدف آزاد شود.
کاربردهای کلیدی مکانیزمهای هدفمندسازی
-
در درمان سرطان: هدفمندسازی فعال با استفاده از لیگاندها و آنتیبادیها باعث میشود که دارو به طور اختصاصی به سلولهای سرطانی متصل شود و سلولهای سالم کمتر آسیب ببینند.
-
در درمان بیماریهای عصبی و عبور از سد خونی-مغزی: نانوذرات هدفمند میتوانند داروها را از سد خونی-مغزی عبور دهند و در درمان بیماریهایی مانند پارکینسون، آلزایمر و تومورهای مغزی موثر باشند.
-
در عفونتهای مقاوم به دارو: نانوذرات هدفمند میتوانند به مکانهای عفونی با تمرکز بالا دارو برسانند و باکتریها یا قارچهای مقاوم به درمان را هدف بگیرند.
-
در دارورسانی به چشم و بیماریهای چشمی: استفاده از نانوذرات هدفمند باعث میشود دارو به شبکیه یا ماکولا برسد و عوارض جانبی در بافتهای سالم کاهش یابد.
مزایای کلیدی مکانیزمهای هدفمندسازی
-
افزایش غلظت دارو در محل هدف
-
کاهش دوز مصرفی و عوارض جانبی
-
افزایش کارایی درمان و کاهش مقاومت دارویی
-
امکان طراحی درمانهای هوشمند و پاسخگو به محیط
-
توانایی ترکیب درمان و تشخیص همزمان (Theranostics)
مکانیزمهای هدفمندسازی، پایه علمی و عملی برای طراحی نانوذرات کارآمد و اختصاصی برای درمان بیماریهای پیچیده هستند و با ترکیب روشهای غیرفعال و فعال، امکان رسیدن به درمانهای شخصیسازیشده و با اثرات درمانی بالا فراهم میشود.
کاربردهای نانو در دارورسانی به بافتها و اندامهای خاص
یکی از مهمترین مزایای دارورسانی هدفمند با نانوذرات، توانایی انتقال دقیق دارو به بافتها و اندامهای خاص است. این کاربردها شامل درمان بیماریهای پیچیده مانند سرطان، بیماریهای عصبی، بیماریهای چشمی، بیماریهای کبدی و عفونتهای مقاوم به دارو میشوند. استفاده از نانوذرات باعث میشود که دارو با تمرکز بالا به محل مورد نظر برسد و اثر درمانی افزایش یابد، در حالی که عوارض جانبی کاهش پیدا میکند.
دارورسانی به تومورها و بافتهای سرطانی
در درمان سرطان، هدفمندسازی نانوذرات به دلیل تراکم بالای رگهای خونی و ویژگیهای نفوذپذیر تومور اهمیت بالایی دارد.
-
نانوذرات میتوانند با استفاده از اثر نفوذپذیری و ماندگاری طولانی (EPR Effect) به صورت غیرفعال در تومور تجمع پیدا کنند.
-
هدفمندسازی فعال با آنتیبادیها، پپتیدها یا لیگاندهای اختصاصی، اتصال اختصاصی به سلولهای سرطانی را فراهم میکند و رهایش دارو در محل هدف اتفاق میافتد.
-
استفاده از نانوذرات مغناطیسی و هدایت مغناطیسی امکان تمرکز بالای دارو در تومورهای عمیق را ایجاد میکند.
-
برخی نانوذرات حساس به pH پایین تومور، دارو را تنها در محیط اسیدی رهایش میکنند و بافتهای سالم آسیب نمیبینند.
این استراتژیها در درمان سرطانهای پستان، ریه، کبد، کولورکتال و مغز کاربرد گسترده دارند و باعث افزایش اثربخشی دارو و کاهش سمیت سیستمیک میشوند.
دارورسانی به مغز و سیستم عصبی مرکزی
یکی از چالشهای بزرگ در دارورسانی، عبور از سد خونی-مغزی (Blood-Brain Barrier) است که داروها را از ورود به مغز محدود میکند. نانوذرات با طراحی مناسب میتوانند این سد را عبور کنند و درمان بیماریهای عصبی مانند پارکینسون، آلزایمر، تومورهای مغزی و سکتههای مغزی را ممکن سازند.
-
نانوذرات پلیمری، لیپیدی و مغناطیسی میتوانند داروهای عصبی را محافظت کرده و با هدفمندسازی فعال به گیرندههای نورونها یا سلولهای گلیال منتقل کنند.
-
سیستمهای مبتنی بر RNA و DNA نانوذرات امکان رهایش دارو و ژن درمانی همزمان را فراهم میکنند.
-
برخی نانوذرات به محرکهای محیطی مغز ( pH، آنزیمها، دما) حساس هستند و دارو را تنها در ناحیه آسیبدیده آزاد میکنند.
دارورسانی به چشم و درمان بیماریهای چشمی
چشم به دلیل ساختار پیچیده و سدهای زیستی مانند سد خونی-شبکیه، دسترسی به بافتهای داخلی آن دشوار است. نانوذرات میتوانند دارو را به صورت هدفمند به شبکیه، ماکولا و عدسی منتقل کنند.
-
نانوذرات لیپیدی و پلیمرهای زیستتخریبپذیر در درمان بیماری ماکولا و دژنراسیون وابسته به سن (AMD) کاربرد دارند.
-
استفاده از نانوذرات چشمدوست با رهایش کنترلشده باعث کاهش دفعات تزریق و افزایش راحتی بیمار میشود.
-
سیستمهای حساس به محیط اسیدی یا آنزیمهای شبکیه دارو را فقط در بافت آسیبدیده آزاد میکنند.
دارورسانی به کبد و درمان بیماریهای کبدی
کبد یکی از اندامهای حیاتی است که در بسیاری از بیماریها مانند فیبروز، هپاتیت و سرطان کبد هدف درمان قرار میگیرد. نانوذرات میتوانند دارو را به سلولهای کبدی منتقل کنند و اثر درمانی را بهبود دهند.
-
نانوذرات لیپیدی و پلیمرهای هدفمند به گیرندههای سلولهای کبدی (Hepatocyte-specific receptors) متصل میشوند و رهایش دارو در محل دقیق صورت میگیرد.
-
ترکیب نانوذرات با طب سنتی چینی یا ترکیبات گیاهی، امکان درمان ترکیبی و افزایش اثربخشی را فراهم میکند.
-
نانوذرات مغناطیسی و معدنی میتوانند هدایت دارو به کبد را تقویت کرده و تجمع دارو در بافت سالم را کاهش دهند.
دارورسانی به استخوان و بافتهای سخت
در بیماریهایی مانند پوکی استخوان، شکستگیها و بازسازی استخوان، انتقال دارو به بافت سخت چالش برانگیز است. نانوذرات با طراحی مناسب میتوانند دارو را به سلولهای استخوانی و ماتریکس استخوانی منتقل کنند.
-
نانوذرات هیدروکسیآپاتیت و نانوذرات معدنی قابلیت اتصال به مینرال ماتریکس استخوان را دارند.
-
نانوذرات حساس به آنزیمها و محیط محلی استخوان، دارو را در محل آسیب دیده آزاد میکنند و فرآیند بازسازی استخوان را تسهیل میکنند.
دارورسانی به بافتهای عفونی و کنترل میکروبهای مقاوم
نانوذرات هدفمند میتوانند دارو را به مکانهای عفونی و میکروبهای مقاوم برسانند و مقاومت دارویی را کاهش دهند.
-
نانوذرات پلیمرهای زیستتخریبپذیر و نانوذرات لیپیدی میتوانند دارو را به بیوفیلمهای میکروبی نفوذ داده و اثر ضد میکروبی را افزایش دهند.
-
استفاده از نانوذرات حساس به محیط اسیدی و آنزیمهای میکروبی باعث رهایش دارو تنها در محل عفونت میشود و آسیب به بافتهای سالم کاهش مییابد.
مزایای استفاده از نانو در دارورسانی به بافتها و اندامهای خاص
-
افزایش تمرکز دارو در محل هدف و کاهش توزیع غیرهدفمند
-
کاهش دوز مصرفی و عوارض جانبی سیستمیک
-
افزایش اثربخشی درمان و کاهش مقاومت دارویی
-
امکان طراحی داروهای رهایش کنترلشده و پاسخگو به محرکهای محیطی
-
ترکیب درمان و تشخیص همزمان (Theranostics)
استفاده از نانوذرات هدفمند برای دارورسانی به بافتها و اندامهای خاص، تحولی بزرگ در پزشکی شخصیسازیشده و درمان بیماریهای پیچیده ایجاد کرده است. با توجه به ویژگیهای هر نوع نانوساختار و مکانیزمهای هدفمندسازی، محققان میتوانند سیستمهای دارورسانی اختصاصی و کارآمد با اثر درمانی بالا و عوارض جانبی کم طراحی کنند.
ترکیب نانو با درمانهای سنتی و داروهای گیاهی
یکی از رویکردهای نوین در دارورسانی هدفمند، ترکیب فناوری نانو با درمانهای سنتی و داروهای گیاهی است. این رویکرد، امکان افزایش اثربخشی دارو، کاهش عوارض جانبی و توسعه درمانهای شخصیسازیشده را فراهم میکند. استفاده از نانوذرات به عنوان حامل داروهای گیاهی، باعث بهبود پایداری، زیست دسترس پذیری و هدفمندسازی میشود.
مزایای ترکیب نانو با داروهای سنتی و گیاهی
-
افزایش حلالیت و زیستدسترسپذیری: بسیاری از ترکیبات گیاهی به دلیل هیدروفوبیک بودن، زیستدسترسپذیری پایینی دارند. نانوذرات میتوانند این ترکیبات را در محیطهای آبی پایدار کنند و جذب آنها را افزایش دهند.
-
محافظت از دارو در برابر تخریب: ترکیبات گیاهی حساس به نور، pH یا آنزیمها هستند. نانوذرات میتوانند از تخریب این داروها جلوگیری کرده و اثر درمانی طولانیمدت ایجاد کنند.
-
هدفمندسازی و رهایش کنترلشده: نانوذرات میتوانند داروهای گیاهی را به بافتها و سلولهای خاص هدایت کنند و با استفاده از محرکهای محیطی ( pH، آنزیمها، دما) دارو را در محل دقیق رهاسازی کنند.
-
کاهش عوارض جانبی: با هدفمندسازی داروهای گیاهی، توزیع غیرهدفمند کاهش یافته و اثرات سمی بر بافتهای سالم محدود میشود.
کاربردهای کلیدی در درمان سرطان
ترکیب نانو با داروهای گیاهی در درمان سرطان، یکی از پیشرفتهترین حوزههای تحقیقاتی است. ترکیبات گیاهی مانند کورکومین، ژنستئین، اپیگالوکاتچین گالات (EGCG) و رزوراترول دارای اثرات ضد سرطانی هستند اما محدودیتهای زیستدسترسپذیری و پایداری دارند.
-
استفاده از لیپوزومها و نانوذرات پلیمری برای بارگذاری کورکومین، باعث افزایش جذب سلولی و اثر ضد توموری آن میشود.
-
ترکیب نانوذرات با نانوذرات هدفمند حاوی لیگاندهای مخصوص سلولهای سرطانی، داروهای گیاهی را به طور اختصاصی به تومور منتقل میکند.
-
نانوذرات حساس به محیط تومور pH) پایین، آنزیمها) امکان رهایش هوشمند دارو را فراهم میکنند و اثرات سیستمیک کاهش مییابد.
ترکیب نانو با درمانهای گیاهی در بیماریهای کبدی
داروهای گیاهی مانند سیلیمارین، کاتچینها و ترکیبات سنتی چینی در درمان بیماریهای کبدی کاربرد دارند. نانوذرات هدفمند میتوانند این ترکیبات را به سلولهای کبدی هدایت کنند و اثرات درمانی را افزایش دهند.
-
استفاده از نانوذرات لیپیدی و پلیمری هدفمند به گیرندههای هپاتوسیت باعث رهایش مستقیم دارو در سلولهای کبدی میشود.
-
تحقیقات نشان دادهاند که ترکیب نانوذرات با داروهای سنتی چینی، باعث بهبود بازسازی بافت کبد و کاهش التهاب میشود.
کاربردهای نانو و داروهای گیاهی در درمان بیماریهای عصبی
ترکیب نانو با داروهای گیاهی برای درمان بیماریهای مغزی مانند آلزایمر و پارکینسون، یک حوزه نوظهور و پرامید است. بسیاری از ترکیبات گیاهی، اثر ضد اکسیدانی و ضد التهابی دارند اما عبور از سد خونی-مغزی محدودیت ایجاد میکند.
-
نانوذرات لیپیدی و پلیمری میتوانند داروهای گیاهی را به نورونها و سلولهای گلیال برسانند.
-
برخی نانوذرات حساس به محیط مغز pH ) ، آنزیمها، دما) دارو را تنها در مناطق آسیبدیده آزاد میکنند.
-
این رویکرد باعث افزایش اثر ضد التهابی و حفاظت از نورونها و کاهش عوارض جانبی سیستمیک میشود.
ترکیب نانو با داروهای ضد میکروبی گیاهی
میکروبهای مقاوم به دارو، یکی از چالشهای بزرگ درمانی هستند. ترکیب نانوذرات با ترکیبات گیاهی ضد میکروب، باعث نفوذ به بیوفیلمها و افزایش اثر ضد میکروبی میشود.
-
نانوذرات لیپیدی و پلیمری میتوانند داروهای گیاهی را به مکانهای عفونی و بیوفیلمهای باکتریایی منتقل کنند.
-
نانوذرات حساس به محیط اسیدی یا آنزیمهای میکروبی، دارو را تنها در محل عفونت آزاد میکنند و آسیب به بافتهای سالم کاهش مییابد.
مزایای کلیدی استفاده از نانو در ترکیب با درمانهای سنتی و داروهای گیاهی
-
افزایش پایداری و زیستدسترسپذیری داروهای گیاهی
-
کاهش دوز مصرفی و عوارض جانبی
-
امکان رهایش هدفمند و کنترلشده داروها
-
افزایش اثر درمانی در بیماریهای پیچیده مانند سرطان، بیماریهای کبدی و عصبی
-
توانایی ترکیب درمان و تشخیص همزمان (Theranostics)
چالشها و چشمانداز آینده
اگرچه ترکیب نانو با داروهای سنتی و گیاهی نویدبخش است، اما چالشهایی نیز وجود دارد:
-
بهینهسازی سطح و ساختار نانوذرات برای افزایش اتصال به سلولهای هدف
-
ارزیابی ایمنی و سمیت طولانیمدت
-
توسعه فرآیندهای تولید صنعتی قابل اطمینان
-
مطالعات بالینی گسترده برای تایید اثرات درمانی
با این حال، تحقیقات پیشرفته نشان میدهند که ترکیب نانو و داروهای گیاهی و سنتی میتواند یک راهکار درمانی جامع و کمخطر برای بیماریهای مزمن و پیچیده ارائه دهد و یکی از مهمترین دستاوردهای پزشکی نوین باشد.
چالشها و محدودیتهای دارورسانی با نانو
با وجود پیشرفتهای چشمگیر در فناوری نانو و دارورسانی هدفمند، هنوز چالشها و محدودیتهای مهمی وجود دارند که توسعه و کاربرد این فناوری را تحت تأثیر قرار میدهند. شناخت دقیق این موانع برای طراحی سیستمهای نانوذرات کارآمد، ایمن و قابل استفاده بالینی ضروری است.
چالشهای فنی و طراحی نانوذرات
-
کنترل اندازه و توزیع ذرات: اندازه نانوذرات یکی از مهمترین فاکتورها در دارورسانی هدفمند است. ذرات بسیار کوچک ممکن است سریع از طریق کلیهها دفع شوند، در حالی که ذرات بزرگتر در سیستم رتیکولو-اندوتلیالی (RES) گرفتار شده و از گردش خون خارج میشوند. بنابراین، بهینهسازی اندازه و توزیع ذرات برای افزایش تجمع در بافت هدف و کاهش توزیع غیرهدفمند ضروری است.
-
پایداری شیمیایی و فیزیکی: نانوذرات ممکن است در طول نگهداری یا بعد از تزریق، دچار تجمع، تخریب یا تغییر سطحی شوند که باعث کاهش اثر دارو و افزایش سمیت میشود. استفاده از پوششدهی مناسب، PEGylation و پلیمرهای پایدار میتواند این مشکل را کاهش دهد.
-
رهایش کنترلشده دارو: طراحی نانوذراتی که دارو را به صورت هوشمند و پاسخگو به محیط آزاد کنند، یک چالش بزرگ است. رهایش غیرمطلوب دارو میتواند عوارض جانبی و کاهش اثر درمانی ایجاد کند.
محدودیتهای بیولوژیکی و ایمنی
-
پاسخ ایمنی و التهاب: نانوذرات ممکن است باعث فعالسازی سیستم ایمنی، التهاب یا تحریک سلولی شوند. این واکنشها میتواند توزیع دارو را مختل کرده و عوارض جانبی ایجاد کند.
-
توزیع غیرهدفمند: حتی با هدفمندسازی فعال، بخشی از نانوذرات ممکن است در کبد، طحال و ریهها تجمع پیدا کنند و باعث سمیت سیستمیک شوند.
-
عبور از سدهای زیستی: عبور از سدهای حیاتی مانند سد خونی-مغزی یا سد شبکیه همچنان یک چالش است و نیازمند طراحی دقیق نانوذرات با ویژگیهای مناسب برای نفوذ به بافت هدف است.
چالشهای تولید و صنعتی
-
تولید در مقیاس صنعتی: بسیاری از نانوذرات آزمایشگاهی در مقیاس کوچک عملکرد مطلوب دارند، اما تولید آنها به صورت صنعتی و با کنترل کیفیت دقیق و یکنواختی یک چالش است.
-
هزینه تولید: ساخت نانوذرات هدفمند و پیچیده هزینهبر است و ممکن است باعث محدود شدن دسترسی به این فناوری در کشورهای با منابع محدود شود.
-
پایداری در طول حمل و نقل: نگهداری و حمل و نقل نانوذرات حساس به شرایط محیطی مانند دما، رطوبت و نور، یک محدودیت عملی است.
چالشهای بالینی و مقرراتی
-
مطالعات بالینی محدود: بسیاری از سیستمهای نانوذرات هنوز در مراحل آزمایشگاهی و حیوانی هستند و اطلاعات کافی درباره ایمنی و اثرات بلندمدت در انسانها وجود ندارد.
-
مقررات و استانداردسازی: عدم وجود استانداردهای بینالمللی جامع برای تولید، ارزیابی و مصرف نانوذرات، مسیر توسعه بالینی و تجاری آنها را پیچیده میکند.
-
تنوع پاسخ فردی: تفاوتهای فردی در فیزیولوژی، سیستم ایمنی و توزیع دارو باعث میشود که اثر نانوذرات در بیماران مختلف متفاوت باشد.
چالشهای ترکیب با درمانهای دیگر
-
همکاری با داروهای شیمیایی یا گیاهی: در ترکیب نانوذرات با داروهای سنتی یا شیمیایی، تعاملات دارویی غیرقابل پیشبینی ممکن است رخ دهد و اثر درمانی یا سمیت را تغییر دهد.
-
داروهای ترکیبی و رهایش همزمان: طراحی سیستمهایی که چند دارو را به صورت هدفمند و همزمان رهاسازی کنند، هنوز یک چالش فناورانه محسوب میشود.
محدودیتهای فناوری و آینده پژوهشی
-
تشخیص و پایش دقیق: توانایی ردیابی نانوذرات در بدن و پایش رهایش دارو هنوز به تکنولوژیهای تصویربرداری و سنجش پیشرفته نیاز دارد.
-
تطبیق با بیماریهای پیچیده: بیماریهایی با بافتهای متغیر و محیطهای فیزیولوژیک متفاوت، طراحی نانوذرات هدفمند را پیچیدهتر میکنند.
-
ایمنی بلندمدت و سمیت تجمعی: مطالعات بلندمدت درباره تجمع نانوذرات در بدن و اثرات زیستمحیطی هنوز محدود است و نیاز به تحقیق بیشتر دارد.
استراتژیهای مقابله با چالشها
برای غلبه بر این محدودیتها، محققان و مهندسان نانو از استراتژیهای متعددی استفاده میکنند:
-
استفاده از پلیمرها و پوششدهی مناسب برای افزایش پایداری و کاهش پاسخ ایمنی
-
طراحی نانوذرات حساس به محیط با رهایش کنترلشده و هوشمند
-
بهینهسازی اندازه، سطح و بار نانوذرات برای افزایش هدفمندی و کاهش تجمع غیرهدفمند
-
توسعه روشهای تصویربرداری و پایش دقیق نانوذرات در بدن
-
انجام مطالعات بالینی و ارزیابی طولانیمدت برای بررسی ایمنی و اثر درمانی
با وجود چالشها و محدودیتها، پیشرفتهای فناورانه و پژوهشهای بالینی نشان میدهند که نانوذرات هدفمند پتانسیل بسیار بالایی در درمان بیماریهای پیچیده دارند و با طراحی مناسب میتوان اثر درمانی را افزایش و عوارض جانبی را به حداقل رساند.
مزایا و نقاط قوت نانو در دارورسانی هدفمند
فناوری نانو در دارورسانی هدفمند، تحولی عظیم در پزشکی مدرن ایجاد کرده است و قابلیتهای متعددی ارائه میدهد که از آن به عنوان یک ابزار درمانی پیشرفته و کارآمد یاد میشود. این مزایا شامل افزایش اثربخشی دارو، کاهش عوارض جانبی، امکان هدفمندسازی دقیق و فراهم کردن زمینه برای درمانهای نوین است.
افزایش تمرکز دارو در محل هدف
یکی از مهمترین مزایای نانوذرات، توانایی تجمع در بافت یا سلول هدف است. با هدفمندسازی فعال یا غیرفعال، نانوذرات میتوانند دارو را به بافتهای آسیبدیده منتقل کنند و از پراکندگی در بافتهای سالم جلوگیری کنند. این ویژگی باعث میشود که:
-
اثربخشی دارو افزایش یابد و نیاز به دوزهای بالای سیستمیک کاهش پیدا کند.
-
اثرات درمانی در بیماریهای پیچیده مانند سرطان، بیماریهای عصبی، کبدی و عفونی بهبود یابد.
-
کاهش اثرات سمی و عوارض جانبی سیستمیک اتفاق بیفتد.
رهایش کنترلشده و پاسخگو به محیط
نانوذرات امکان رهایش دارو به صورت کنترلشده و هوشمند را فراهم میکنند. این رهایش میتواند بر اساس محرکهای محیطی مانند:
-
pH پایین محیط تومور
-
آنزیمهای خاص بافت هدف
-
دما و شرایط اکسیداتیو
انجام شود. این ویژگی باعث میشود که دارو فقط در محل مورد نیاز آزاد شود و از اثرات غیرهدفمند جلوگیری شود.
افزایش زیستدسترسپذیری و پایداری دارو
بسیاری از داروها، به ویژه ترکیبات گیاهی و برخی داروهای شیمیایی، دارای پایداری و زیستدسترسپذیری پایین هستند. نانوذرات میتوانند دارو را در برابر تخریب محیطی محافظت کنند و جذب سلولی را افزایش دهند:
-
داروهای هیدروفوبیک میتوانند در نانوذرات لیپیدی یا پلیمری پایدار شوند.
-
داروهای حساس به نور، آنزیم یا pH با نانوذرات محافظت میشوند.
-
زیستدسترسپذیری دارو افزایش یافته و اثر درمانی طولانیتر میشود.
کاهش عوارض جانبی و افزایش ایمنی
با هدفمندسازی دارو و رهایش کنترلشده، توزیع دارو در بافتهای سالم کاهش مییابد و عوارض جانبی سیستمیک محدود میشود. این مزیت به ویژه در داروهای شیمیدرمانی و داروهای ضد التهابی با اثرات سمی بالا اهمیت دارد.
توانایی ترکیب درمان و تشخیص همزمان (Theranostics)
یکی دیگر از نقاط قوت نانو، امکان ادغام دارورسانی و تشخیص بیماریها در یک سیستم واحد است:
-
نانوذرات میتوانند همزمان دارو را به بافت هدف منتقل کرده و تصویربرداری پزشکی یا تشخیص مولکولی را انجام دهند.
-
این ویژگی باعث میشود که پایش روند درمان و تنظیم دوز دارو به صورت دقیقتر انجام شود.
انعطافپذیری در طراحی و کاربردهای متنوع
نانوذرات از نظر اندازه، شکل، سطح و مواد سازنده قابل تنظیم هستند و میتوان آنها را برای بافتها و بیماریهای مختلف طراحی کرد:
-
لیپوزومها، نانوذرات پلیمری، نانوذرات مغناطیسی، نانوذرات معدنی و نانوذرات DNA هر کدام قابلیتها و کاربردهای خاص خود را دارند.
-
این انعطافپذیری باعث میشود که سیستمهای دارورسانی متنوع و سفارشی برای انواع بیماریها ایجاد شود.
افزایش اثر درمانی در بیماریهای مقاوم و پیچیده
استفاده از نانوذرات در دارورسانی هدفمند، اثر دارو را در بیماریهای مقاوم و پیچیده بهبود میبخشد:
-
در سرطانهای مقاوم به دارو، نانوذرات میتوانند دارو را به سلولهای مقاوم منتقل کنند و مسیرهای مقاومت دارویی را دور بزنند.
-
در عفونتهای میکروبی مقاوم به دارو، نانوذرات میتوانند به بیوفیلمها نفوذ کنند و اثر ضد میکروبی را افزایش دهند.
-
در بیماریهای عصبی و مغزی، عبور از سد خونی-مغزی با نانوذرات ممکن شده و اثر درمانی افزایش مییابد.
قابلیت ترکیب با داروهای گیاهی و سنتی
یکی از مزایای منحصربهفرد نانو، امکان ترکیب با داروهای سنتی و گیاهی است:
-
افزایش زیستدسترسپذیری و پایداری ترکیبات گیاهی
-
هدفمندسازی داروهای سنتی به بافتهای آسیبدیده
-
کاهش عوارض جانبی و افزایش اثر درمانی
صرفهجویی در دوز دارویی و هزینههای درمانی
با افزایش هدفمندی و اثر درمانی دارو، نیاز به دوزهای بالای سیستمیک کاهش مییابد. این موضوع نه تنها عوارض جانبی را کم میکند، بلکه باعث صرفهجویی در هزینههای درمان و مصرف دارو نیز میشود.
پتانسیل در پزشکی شخصیسازیشده
نانوذرات هدفمند امکان طراحی درمانهای شخصیسازیشده بر اساس ویژگیهای فردی بیمار را فراهم میکنند:
-
طراحی سیستمهای دارورسانی متناسب با نوع بیماری، بافت هدف و پاسخ بیولوژیکی فرد
-
امکان پایش دقیق اثر درمان و اصلاح دوز در زمان واقعی
-
ترکیب درمان و تشخیص برای افزایش دقت و کاهش خطای درمان
چشمانداز آینده و توسعه فناوری نانو در دارورسانی
مزایای نانو در دارورسانی هدفمند، آینده روشنی برای پزشکی نوین رقم زده است:
-
توسعه سیستمهای هوشمند رهایش دارو با حساسیت بالا به محرکهای محیطی
-
ترکیب دارورسانی با تشخیص مولکولی و تصویربرداری پزشکی
-
افزایش کاربرد در بیماریهای پیچیده، مقاوم و مزمن
-
امکان ادغام با داروهای گیاهی و سنتی برای افزایش اثر درمانی
-
طراحی سیستمهای هدفمند چنددارویی برای درمان ترکیبی بیماریها
استفاده از فناوری نانو در دارورسانی هدفمند، یک انقلاب درمانی و تحولی بنیادین در پزشکی مدرن محسوب میشود. این فناوری با ارائه مزایای کلیدی مانند هدفمندسازی دقیق، رهایش کنترلشده، افزایش زیستدسترسپذیری و کاهش عوارض جانبی، نقش حیاتی در بهبود کیفیت درمان و افزایش اثربخشی داروها ایفا میکند.
پیشرفتهای اخیر و تحقیقات نوین در دارورسانی هدفمند با نانو
در سالهای اخیر، فناوری نانو تحولات چشمگیری در دارورسانی هدفمند ایجاد کرده است. پیشرفتها در طراحی نانوذرات هوشمند، هدفمندسازی فعال و غیرفعال، رهایش کنترلشده و ترکیب با تشخیص و تصویربرداری پزشکی، امکان توسعه درمانهای نوین و شخصیسازیشده را فراهم کرده است.
نانوذرات هوشمند و واکنشپذیر
یکی از مهمترین پیشرفتها، توسعه نانوذرات هوشمند پاسخگو به محرکهای محیطی است. این نانوذرات قادرند دارو را تنها در محیط خاص آزاد کنند و واکنش به محرکهایی مانند:
-
pH پایین بافتهای توموری یا التهابی
-
آنزیمهای اختصاصی بافت هدف
-
دمای موضعی یا شرایط اکسیداتیو
این ویژگیها باعث افزایش هدفمندی، کاهش عوارض جانبی و افزایش اثر درمانی میشوند. تحقیقات نوین نشان دادهاند که نانوذرات پلیمری حساس به pH و نانوذرات مغناطیسی با قابلیت هدایت خارجی، اثرگذاری فوقالعادهای در درمان سرطان و بیماریهای کبدی دارند.
ترکیب دارورسانی و تشخیص (Theranostics)
یکی از نوآوریهای مهم، ترکیب دارورسانی با تشخیص مولکولی و تصویربرداری پزشکی است. این رویکرد که به نام Theranostics شناخته میشود، امکان پایش دقیق روند درمان و تنظیم دوز دارو در زمان واقعی را فراهم میکند:
-
استفاده از نانوذرات مغناطیسی و فلورسانسدار برای ردیابی دارو در بدن
-
همزمان انجام تصویربرداری MRI یا CT و انتقال داروی هدفمند
-
افزایش دقت درمان و کاهش خطای پزشکی
نانوذرات DNA و RNA
استفاده از نانوذرات DNA و RNA یکی از پیشرفتهای چشمگیر در دارورسانی هدفمند است. این نانوذرات میتوانند:
-
داروهای کوچک مولکولی، siRNA و miRNA را به سلولهای هدف منتقل کنند
-
قابلیت طراحی دقیق و کنترل فضایی و زمانی رهایش دارو را دارند
-
در درمان بیماریهای ژنتیکی، سرطان و عفونتهای مقاوم به دارو نقش مهمی دارند
نانوذرات مغناطیسی و هدایت خارجی
نانوذرات مغناطیسی با قابلیت هدایت به کمک میدان مغناطیسی خارجی، امکان تمرکز دارو در محل هدف را فراهم میکنند:
-
افزایش تمرکز دارو در بافت هدف و کاهش توزیع غیرهدفمند
-
امکان ترکیب با تصویربرداری مغناطیسی (MRI) برای پایش دقیق دارو
-
کاربرد در درمان سرطان، عفونتها و بیماریهای عصبی
ترکیب نانو با داروهای گیاهی و سنتی
تحقیقات نوین نشان میدهند که ترکیب نانو با داروهای گیاهی و سنتی باعث افزایش اثر درمانی و کاهش عوارض جانبی میشود:
-
نانوذرات لیپیدی و پلیمری برای داروهای هیدروفوبیک گیاهی
-
هدفمندسازی ترکیبات گیاهی به بافتهای آسیبدیده
-
استفاده از نانوذرات حساس به محیط برای رهایش هوشمند دارو
پیشرفتها در دارورسانی به سیستم عصبی مرکزی
عبور از سد خونی-مغزی یکی از بزرگترین چالشها در دارورسانی داروهای مغزی است. تحقیقات نوین با استفاده از نانوذرات مختلف، پیشرفتهای مهمی ایجاد کردهاند:
-
نانوذرات لیپیدی و پلیمری با پوشش PEG و لیگاندهای هدفمند
-
استفاده از راههای بینی-مغز (Nose-to-Brain) برای افزایش اثر درمانی در بیماریهای عصبی
-
انتقال موثر داروهای ضد آلزایمر، پارکینسون و داروهای ضد التهابی به نورونها
نانوذرات برای درمان سرطان مقاوم به دارو
تحقیقات اخیر نشان دادهاند که نانوذرات قادر به دور زدن مقاومت دارویی در سلولهای سرطانی هستند:
-
استفاده از نانوذرات حاوی چند دارو برای حمل ترکیبی
-
هدفمندسازی فعال با استفاده از لیگاندهای اختصاصی گیرندههای تومور
-
نانوذرات حساس به محیط تومور برای رهایش هوشمند دارو
ترکیب نانو با سیستمهای ایمنی و ایمونوتراپی
یکی از زمینههای نوظهور، ترکیب نانوذرات با ایمونوتراپی و واکسیناسیون هدفمند است:
-
نانوذرات میتوانند آنتیژنها و داروهای فعالکننده سیستم ایمنی را به سلولهای ارائهدهنده آنتیژن منتقل کنند
-
افزایش پاسخ ایمنی در درمان سرطان و بیماریهای عفونی
-
کاهش دوزهای مورد نیاز و اثرات سیستمیک
تحقیقات بالینی و مطالعات موفق اخیر
چندین مطالعه بالینی و پیشبالینی نشان دادهاند که نانوذرات هدفمند:
-
در درمان سرطانهای متاستاتیک و تومورهای مقاوم موفق عمل کردهاند.
-
در دارورسانی به بافتهای عصبی و کبدی اثرات قابل توجهی داشتهاند.
-
ترکیب نانو با داروهای گیاهی در درمان التهاب، کبد و بیماریهای مزمن مفید بوده است.
چشمانداز آینده تحقیقات نوین
با توجه به پیشرفتهای اخیر، آینده دارورسانی هدفمند با نانو شامل موارد زیر خواهد بود:
-
توسعه نانوذرات هوشمند چنددارویی با قابلیت رهایش کنترلشده و هدفمند
-
ترکیب نانو با داروهای سنتی و گیاهی برای درمان بیماریهای مقاوم و پیچیده
-
ادغام دارورسانی با تصویربرداری و تشخیص پزشکی برای Theranostics
-
استفاده از نانوذرات DNA و RNA برای درمان بیماریهای ژنتیکی و سرطان
-
بهبود روشهای صنعتی و بالینی تولید نانوذرات با کنترل کیفیت بالا
چشمانداز آینده و نوآوریها در دارورسانی هدفمند با نانو
با پیشرفت روزافزون فناوری نانو، دارورسانی هدفمند به یک حوزه پویا و نوآورانه در پزشکی تبدیل شده است. چشمانداز آینده این فناوری شامل طراحی نانوذرات هوشمند، درمانهای شخصیسازیشده، ترکیب دارو و تشخیص همزمان و توسعه کاربردهای نوین در بیماریهای مقاوم و پیچیده است.
نانوذرات هوشمند و واکنشپذیر نسل آینده
یکی از روندهای آینده، توسعه نانوذرات هوشمند نسل بعدی است که قادر به پاسخ به محرکهای متعدد به صورت همزمان هستند. این نانوذرات میتوانند:
-
به تغییرات pH، دما، آنزیمها و شرایط اکسیداتیو واکنش نشان دهند.
-
داروهای مختلف را به صورت همزمان و کنترلشده رهاسازی کنند.
-
در بیماریهای مقاوم مانند سرطان، آلزایمر و پارکینسون کارایی بالایی داشته باشند.
این نوع نانوذرات به محققان امکان میدهد تا سیستمهای دارورسانی دقیق و هوشمند طراحی کنند که اثر درمانی را افزایش داده و عوارض جانبی را به حداقل برساند.
ترکیب دارورسانی با تشخیص و تصویربرداری Theranostics) پیشرفته)
چشمانداز آینده شامل توسعه سیستمهای Theranostics پیشرفته است که دارو و تشخیص را همزمان ترکیب میکنند:
-
استفاده از نانوذرات فلورسانسدار، مغناطیسی یا اپتیکی برای ردیابی دقیق دارو در بافت هدف
-
امکان پایش و اصلاح دوز دارو در زمان واقعی
-
طراحی سیستمهای چندمنظوره برای تشخیص مولکولی، تصویربرداری پزشکی و رهایش دارو
این فناوری به پزشکان امکان میدهد تا درمانهای دقیق، سریع و کارآمد برای بیماریهای پیچیده ارائه دهند.
نانوذرات DNA و RNA و درمان ژنتیکی شخصیسازیشده
یکی دیگر از نوآوریهای آینده، استفاده از نانوذرات DNA و RNA در دارورسانی هدفمند و درمان ژنتیکی است:
-
انتقال siRNA، miRNA و داروهای ژنی به سلولهای هدف
-
طراحی نانوذرات با قابلیت کنترل فضایی و زمانی رهایش دارو
-
استفاده در درمان بیماریهای ژنتیکی، سرطان و اختلالات عصبی
این رویکرد به سوی پزشکی دقیق و شخصیسازیشده پیش میرود و امکان درمان بیمار بر اساس ویژگیهای فردی ژنتیکی و مولکولی را فراهم میکند.
ترکیب نانو با درمانهای گیاهی و سنتی نوین
ترکیب نانوذرات با داروهای سنتی و گیاهی یکی دیگر از روندهای مهم است:
-
افزایش زیستدسترسپذیری و پایداری ترکیبات گیاهی
-
هدفمندسازی داروهای سنتی به بافتهای آسیبدیده
-
کاهش اثرات جانبی و افزایش اثر درمانی در بیماریهای مزمن و پیچیده
این نوآوری میتواند مسیر جدیدی برای ترکیب علم نوین و پزشکی سنتی ایجاد کند و درمانهای کمعوارض و موثر ارائه دهد.
نانوذرات چنددارویی و درمان ترکیبی آینده
یکی از چشماندازهای مهم، توسعه نانوذرات چند دارویی است که قادر به حمل و رهایش چند دارو به صورت هدفمند و کنترلشده هستند:
-
ترکیب داروهای شیمیایی، گیاهی و ایمونوتراپی در یک سیستم
-
افزایش اثر درمانی در بیماریهای مقاوم و تومورهای پیچیده
-
کاهش نیاز به دوزهای بالای دارو و عوارض جانبی
این فناوری امکان ارائه درمانهای ترکیبی هوشمند را فراهم میکند که به شکل اختصاصی برای بیمار طراحی شدهاند.
پیشرفت در دارورسانی به سیستم عصبی مرکزی
عبور از سد خونی-مغزی یکی از مهمترین چالشهای آینده است. تحقیقات آینده به دنبال طراحی نانوذرات با قابلیت:
-
نفوذ بیشتر به بافت مغزی
-
رهایش دارو به نورونها و سلولهای گلیال به صورت هدفمند
-
استفاده از مسیرهای بینی-مغز و پوششدهی هوشمند
این فناوری چشمانداز جدیدی برای درمان بیماریهای عصبی پیچیده مانند آلزایمر، پارکینسون و سکتههای مغزی ایجاد میکند.
ادغام نانو با سیستم ایمنی و ایمونوتراپی
یکی از نوآوریهای آینده، ترکیب نانوذرات با ایمونوتراپی و واکسیناسیون هدفمند است:
-
انتقال آنتیژنها و داروهای فعالکننده سیستم ایمنی به سلولهای ارائهدهنده آنتیژن
-
افزایش پاسخ ایمنی در درمان سرطان و بیماریهای عفونی
-
کاهش دوزهای مورد نیاز و عوارض سیستمیک
هوشمندسازی و شخصیسازی درمانها
چشمانداز آینده دارورسانی هدفمند با نانو به سمت پزشکی شخصیسازیشده حرکت میکند:
-
طراحی سیستمهای دارورسانی متناسب با ویژگیهای فردی بیمار و نوع بیماری
-
امکان پایش اثر درمان و اصلاح دوز در زمان واقعی
-
افزایش دقت و کاهش عوارض جانبی درمان
پیشرفت در تولید و استانداردسازی نانوذرات
یکی از چالشهای فعلی، تولید صنعتی و استانداردسازی نانوذرات است. چشمانداز آینده شامل:
-
توسعه روشهای تولید صنعتی با کیفیت و یکنواختی بالا
-
کاهش هزینههای تولید و افزایش دسترسی به نانوذرات هدفمند
-
بهبود پایداری نانوذرات در طول نگهداری و حمل و نقل
چشمانداز ترکیبی و بینرشتهای
آینده دارورسانی هدفمند با نانو، به شکل بینرشتهای و ترکیبی پیش میرود:
-
ادغام نانو با داروشناسی، فیزیولوژی، ژنتیک و علوم داده
-
طراحی درمانهای دقیق و هوشمند با استفاده از هوش مصنوعی و شبیهسازی مولکولی
-
توسعه سیستمهای دارورسانی چندمنظوره، پاسخگو و شخصیسازیشده
جمعبندی و نتیجهگیری در دارورسانی هدفمند با نانو
دارورسانی هدفمند با استفاده از فناوری نانو، یکی از مهمترین و نوآورانهترین حوزههای پزشکی و داروسازی است که در دو دهه اخیر شاهد پیشرفتهای چشمگیر بوده است. این فناوری توانسته است مشکلات اساسی دارورسانی سنتی مانند پخش غیرهدفمند دارو، اثرات جانبی گسترده، عدم دسترسی دارو به بافتهای خاص و مقاومت دارویی را به شکل قابل توجهی کاهش دهد.
اهمیت و ضرورت نانو در دارورسانی هدفمند
با توجه به پیچیدگی بیماریهای مزمن، تومورهای مقاوم و اختلالات عصبی، استفاده از نانوذرات هوشمند و هدفمند ضرورت یافته است. این ذرات قادرند:
-
داروها را به طور دقیق به بافتها و سلولهای هدف منتقل کنند
-
رهایش کنترلشده و زمانبندیشده دارو را فراهم کنند
-
اثرات جانبی دارو را کاهش دهند و کارایی درمان را افزایش دهند
انواع نانوذرات و کاربردهای آنها
در این مقاله به طور کامل بررسی شد که انواع نانوذرات شامل:
-
نانوذرات پلیمری برای داروهای آبگریز و رهایش کنترلشده
-
لیپوزومها و نانوذرات لیپیدی برای افزایش زیستدسترسپذیری
-
نانوذرات مغناطیسی برای هدایت خارجی و ردیابی دارو
-
نانوذرات DNA و RNA برای درمانهای ژنتیکی و مولکولی
هر یک از این نانوذرات، ویژگیهای منحصر به فردی دارند که در هدفمندسازی فعال و غیرفعال، رهایش پاسخگو به محیط و کاربردهای کلینیکی نقش اساسی ایفا میکنند.
مکانیزمهای هدفمندسازی
مکانیزمهای هدفمندسازی شامل هدفمندسازی فعال، هدفمندسازی غیرفعال و استفاده از محرکهای محیطی هستند که هر یک مزایا و محدودیتهای خاص خود را دارند:
-
هدفمندسازی فعال با استفاده از لیگاندها، آنتیبادیها و پپتیدها، دارو را مستقیماً به سلولهای هدف هدایت میکند.
-
هدفمندسازی غیرفعال بر اساس ویژگیهای بیولوژیکی بافت مانند نفوذپذیری موضعی تومور (EPR effect) عمل میکند.
-
محرکهای محیطی مانند pH، دما و آنزیمها، رهایش دارو را دقیق و هوشمند میکنند.
کاربردهای کلینیکی و بافتهای هدف
نانوذرات هدفمند در درمان سرطان، بیماریهای عصبی، کبد، چشم، استخوان و عفونتهای مقاوم کاربرد وسیع دارند. تحقیقات نوین نشان دادهاند که:
-
دارورسانی به سیستم عصبی مرکزی با عبور از سد خونی-مغزی امکانپذیر شده است.
-
ترکیب نانو با داروهای گیاهی و سنتی اثر درمانی را افزایش داده و عوارض جانبی را کاهش میدهد.
-
استفاده از نانوذرات چنددارویی و ترکیبی، در درمان بیماریهای مقاوم و تومورهای پیچیده مؤثر است.
مزایا و نقاط قوت نانو در دارورسانی هدفمند
مزایای کلیدی نانو در دارورسانی هدفمند شامل:
-
افزایش دقت و هدفمندی دارو
-
کاهش دوز و عوارض جانبی داروها
-
امکان دارورسانی به بافتهای غیرقابل دسترس
-
رهایش هوشمند و کنترلشده دارو
-
پتانسیل در درمان ترکیبی و شخصیسازیشده
این مزایا، نانو را به یک ابزار حیاتی در پزشکی مدرن و آیندهنگر تبدیل کرده است.
چالشها و محدودیتها
با وجود دستاوردهای گسترده، چالشهایی نیز در مسیر استفاده از نانو در دارورسانی هدفمند وجود دارد:
-
تولید صنعتی و استانداردسازی نانوذرات هنوز محدودیتهایی دارد.
-
ایمنی و سمیت طولانیمدت نانوذرات در بدن نیازمند بررسی بیشتر است.
-
هزینه تولید و فناوریهای پیشرفته ممکن است مانع استفاده گسترده در درمانهای بالینی شود.
نوآوریها و چشمانداز آینده
چشمانداز آینده دارورسانی هدفمند با نانو شامل:
-
توسعه نانوذرات هوشمند چنددارویی و پاسخگو به محرکهای متعدد
-
ترکیب داروهای نوین، گیاهی و ایمونوتراپی در یک سیستم واحد
-
استفاده از Theranostics برای درمان و تشخیص همزمان
-
شخصیسازی درمانها بر اساس ویژگیهای ژنتیکی و مولکولی بیمار
-
پیشرفت در تولید صنعتی، استانداردسازی و مقرونبهصرفه شدن نانوذرات
در مجموع، فناوری نانو در دارورسانی هدفمند به انقلابی در پزشکی و داروسازی مدرن تبدیل شده است. این فناوری امکان درمان بیماریهای پیچیده و مقاوم، کاهش اثرات جانبی داروها و افزایش اثربخشی درمان را فراهم کرده است. پیشرفتهای اخیر و تحقیقات نوین نشان میدهند که آینده دارورسانی هدفمند با نانو، به سمت هوشمندسازی، شخصیسازی، ترکیب درمانها و ادغام با تشخیص پزشکی حرکت میکند و افقهای جدیدی برای درمان بیماران باز خواهد کرد.
سوالات متداول (FAQ) درباره دارورسانی هدفمند با نانو
نانو در دارورسانی هدفمند دقیقاً چیست؟
نانو در دارورسانی هدفمند به استفاده از ذرات بسیار کوچک در مقیاس نانومتر (۱ تا ۱۰۰ نانومتر) گفته میشود که میتوانند داروها را به صورت هدفمند و کنترلشده به بافتها، سلولها یا اندامهای خاص منتقل کنند. این فناوری امکان کاهش اثرات جانبی دارو و افزایش اثر درمانی را فراهم میکند.
چگونه نانوذرات دارو را به بافت هدف میرسانند؟
نانوذرات از طریق هدفمندسازی فعال، هدفمندسازی غیرفعال و پاسخ به محرکهای محیطی دارو را به بافت هدف منتقل میکنند:
-
هدفمندسازی فعال: استفاده از لیگاندها، آنتیبادیها و پپتیدها برای اتصال مستقیم به سلول هدف.
-
هدفمندسازی غیرفعال: تکیه بر ویژگیهای بیولوژیکی بافت مانند نفوذپذیری موضعی تومور (EPR effect).
-
پاسخ به محرکها: رهایش دارو در محیط خاص بر اساس pH، آنزیمها یا دما.
مزایای استفاده از نانو در دارورسانی چیست؟
-
افزایش دقت و هدفمندی دارو
-
کاهش دوز و عوارض جانبی
-
دارورسانی به بافتهای غیرقابل دسترس
-
رهایش هوشمند و کنترلشده دارو
-
امکان ترکیب درمانها و شخصیسازی درمانها
آیا نانوذرات برای همه داروها قابل استفاده هستند؟
تقریباً اکثر داروها میتوانند از طریق نانوذرات هدفمند منتقل شوند، اما ویژگی فیزیکوشیمیایی دارو، پایداری، محلولیت و هدف درمانی تعیینکننده نوع نانوذره مناسب است. به عنوان مثال، داروهای آبگریز بیشتر با نانوذرات لیپیدی یا پلیمرهای حساس به محیط منتقل میشوند.
نانوذرات چگونه میتوانند عبور از سد خونی-مغزی را ممکن کنند؟
استفاده از نانوذرات با پوشش مناسب و لیگاندهای هدفمند، یا مسیرهای بینی-مغز (Nose-to-Brain)، امکان عبور دارو از سد خونی-مغزی را فراهم میکند. این روشها برای درمان بیماریهای عصبی پیچیده مانند آلزایمر و پارکینسون بسیار کاربردی هستند.
آیا نانوذرات برای درمان سرطان مفید هستند؟
بله. نانوذرات در درمان سرطان نقش کلیدی دارند:
-
هدایت دارو به سلولهای سرطانی مقاوم
-
کاهش انتشار دارو به بافتهای سالم و کاهش عوارض جانبی
-
امکان ترکیب داروهای مختلف در یک نانوذره برای درمان ترکیبی هوشمند
-
ردیابی درمان با Theranostics
آیا نانوذرات با داروهای گیاهی و سنتی ترکیب میشوند؟
بله. تحقیقات اخیر نشان دادهاند که ترکیب نانوذرات با داروهای سنتی و گیاهی:
-
اثر درمانی ترکیبات را افزایش میدهد
-
زیستدسترسپذیری داروهای گیاهی را افزایش میدهد
-
عوارض جانبی را کاهش میدهد
آیا استفاده از نانوذرات خطرناک است؟
اکثر نانوذرات طراحی شده برای دارورسانی زیستسازگار و ایمن هستند، اما هنوز بررسیهای بلندمدت ایمنی و سمیت در انسان نیاز است. انتخاب نوع نانوذره، پوششدهی و دوز مناسب، نقش مهمی در کاهش ریسک دارد.
نانوذرات چگونه میتوانند درمانهای شخصیسازیشده را ممکن کنند؟
با استفاده از نانوذرات هوشمند و پاسخگو، دارو میتواند بر اساس ویژگیهای ژنتیکی و مولکولی بیمار و محل بیماری طراحی و رهاسازی شود. این امر امکان ایجاد درمان اختصاصی و دقیق برای هر بیمار را فراهم میکند.
چشمانداز آینده دارورسانی هدفمند با نانو چیست؟
-
توسعه نانوذرات چنددارویی و واکنشپذیر به محرکهای متعدد
-
ترکیب داروهای نوین، سنتی و ایمونوتراپی در یک سیستم
-
ایجاد Theranostics پیشرفته برای تشخیص و درمان همزمان
-
پیشرفت در تولید صنعتی و استانداردسازی نانوذرات
-
شخصیسازی درمانها بر اساس ویژگیهای فردی بیمار و بیماری
آیا نانو میتواند جایگزین درمانهای سنتی شود؟
نانو به عنوان ابزار مکمل و تقویتکننده درمانهای موجود عمل میکند و میتواند اثربخشی درمانها را افزایش دهد. هدف اصلی، ترکیب درمانهای سنتی و نوین برای دستیابی به بهترین نتایج درمانی است.
چه بیماریهایی بیشترین بهره را از دارورسانی نانو میبرند؟
-
سرطانهای مقاوم و متاستاتیک
-
بیماریهای عصبی و مغزی
-
بیماریهای کبدی و چشمی
-
عفونتهای مقاوم به دارو
-
بیماریهای التهابی مزمن و سیستمیک
چگونه میتوانم اطلاعات بیشتری درباره نانو در دارورسانی هدفمند کسب کنم؟
برای کسب اطلاعات بیشتر، میتوانید به مطالعات علمی بهروز، مقالات مروری و منابع دانشگاهی معتبر مراجعه کنید و از جدیدترین تحقیقات در زمینه نانو، دارورسانی و فناوریهای هدفمند مطلع شوید.