نانو پزشکی برای درمان سرطان
مقدمه
سرطان یکی از پیچیدهترین و چالشبرانگیزترین بیماریهای قرن حاضر است که هر ساله میلیونها نفر را در سراسر جهان تحت تأثیر قرار میدهد. این بیماری به دلیل تکثیر غیرقابل کنترل سلولها و توانایی آنها در نفوذ به بافتهای سالم و گسترش به سایر اندامها، درمان دشواری دارد. با وجود پیشرفتهای قابل توجه در حوزههای جراحی، شیمیدرمانی و پرتو درمانی، هنوز محدودیتهای مهمی در کنترل کامل سرطان وجود دارد. این محدودیتها شامل تغییرپذیری ژنتیکی سلولهای سرطانی، مقاومت دارویی، سمیت بالای درمانها و آسیب به بافتهای سالم است.
در دهههای اخیر، پیشرفتهای علمی در زمینه علوم نانو، مسیر جدیدی برای درمان سرطان با دقت و اثربخشی بالاتر فراهم کرده است. نانوپزشکی به عنوان یک رویکرد نوین، امکان طراحی و استفاده از نانوذرات با ویژگیهای منحصر به فرد فیزیکی و شیمیایی را فراهم میکند که قادرند داروها، مولکولهای درمانی و حتی عوامل تشخیصی را به صورت هدفمند به سلولهای سرطانی منتقل کنند. این رویکرد نویدبخش کاهش عوارض جانبی، افزایش اثر دارویی و بهبود کیفیت زندگی بیماران است.
یکی از نکات کلیدی در نانوپزشکی، توانایی نانوذرات در عبور از موانع زیستی و تجمع در محل تومور با دقت بالا است. نانوذرات به دلیل ابعاد بسیار کوچک خود، قابلیت نفوذ در بافتها، حمل داروهای حساس به محیط و رهایش کنترلشده مولکولهای فعال را دارند. این ویژگیها باعث میشود که نانوپزشکی بتواند محدودیتهای داروهای سنتی مانند تجزیه سریع در بدن، دفع غیرهدفمند و سمیت سیستمیک را برطرف کند.
علاوه بر این، نانوپزشکی امکان ترکیب درمان و تشخیص همزمان (Theranostics) را فراهم میکند. با استفاده از نانوذرات، پزشکان میتوانند همزمان فرآیند پیشرفت تومور را رصد کنند و داروها را به صورت هوشمند آزاد کنند، که این امر موجب افزایش دقت درمان و کاهش اثرات جانبی میشود.
تحقیقات اخیر نشان میدهد که نانوپزشکی میتواند در انواع سرطانها از جمله سرطان پستان، ریه، کبد، مغز و سرطانهای مرتبط با سلولهای بنیادی سرطانی نقش موثری ایفا کند. از این رو، توسعه و بهینهسازی سیستمهای نانوذرهای، هدفمند و چندکاره، به یکی از اولویتهای اصلی علوم پزشکی و داروسازی تبدیل شده است.
چرا نانوپزشکی مهم است؟
-
افزایش اثربخشی درمان: نانوذرات میتوانند داروها را دقیقاً به سلولهای سرطانی برسانند و از پراکندگی غیرضروری در بدن جلوگیری کنند.
-
کاهش عوارض جانبی : با هدایت هدفمند دارو، بافتهای سالم کمتر تحت تأثیر دارو قرار میگیرند.
-
تشخیص زودهنگام و نظارت بر درمان : نانوذرات میتوانند به عنوان عوامل تصویربرداری و پایشکننده وضعیت تومور عمل کنند.
-
توسعه درمانهای ترکیبی : امکان ترکیب نانوپزشکی با شیمیدرمانی، ایمونوتراپی و پرتو درمانی برای افزایش اثربخشی.
با وجود تمام این مزایا، نانوپزشکی هنوز در مسیر کامل شدن و استفاده گسترده بالینی قرار دارد و چالشهایی مانند ایمنی طولانیمدت، تولید انبوه و استانداردسازی وجود دارد که باید در تحقیقات و مطالعات بالینی برطرف شوند.
هدف این مقاله، ارائه یک مرور جامع و دقیق از نانوپزشکی در درمان سرطان است. در این مقاله، ما به بررسی مفصل تعریف نانوپزشکی، انواع نانوذرات، مکانیسمهای هدفگیری، کاربردهای کلینیکی، نانوپزشکی پاسخگو به محرکها، درمان سرطانهای خاص، ترکیب با درمانهای دیگر، چالشها و چشمانداز آینده خواهیم پرداخت. تمامی اطلاعات ارائهشده در این مقاله براساس جدیدترین منابع علمی و مطالعات معتبر بینالمللی است تا خوانندگان و متخصصان، دیدگاهی جامع، دقیق و کاربردی از نانوپزشکی داشته باشند.
در نهایت، مقدمه این مقاله پایهای مستحکم برای درک عمق و گستره نانوپزشکی در درمان سرطان فراهم میکند و مسیر مطالعه بخشهای بعدی را هموار میسازد. خواننده پس از مطالعه این مقدمه، آماده است تا با جزئیات فنی و پیشرفتهتر انواع نانوذرات و کاربردهای بالینی آنها در درمان سرطان آشنا شود.
مفهوم نانوپزشکی و کاربرد آن در سرطان
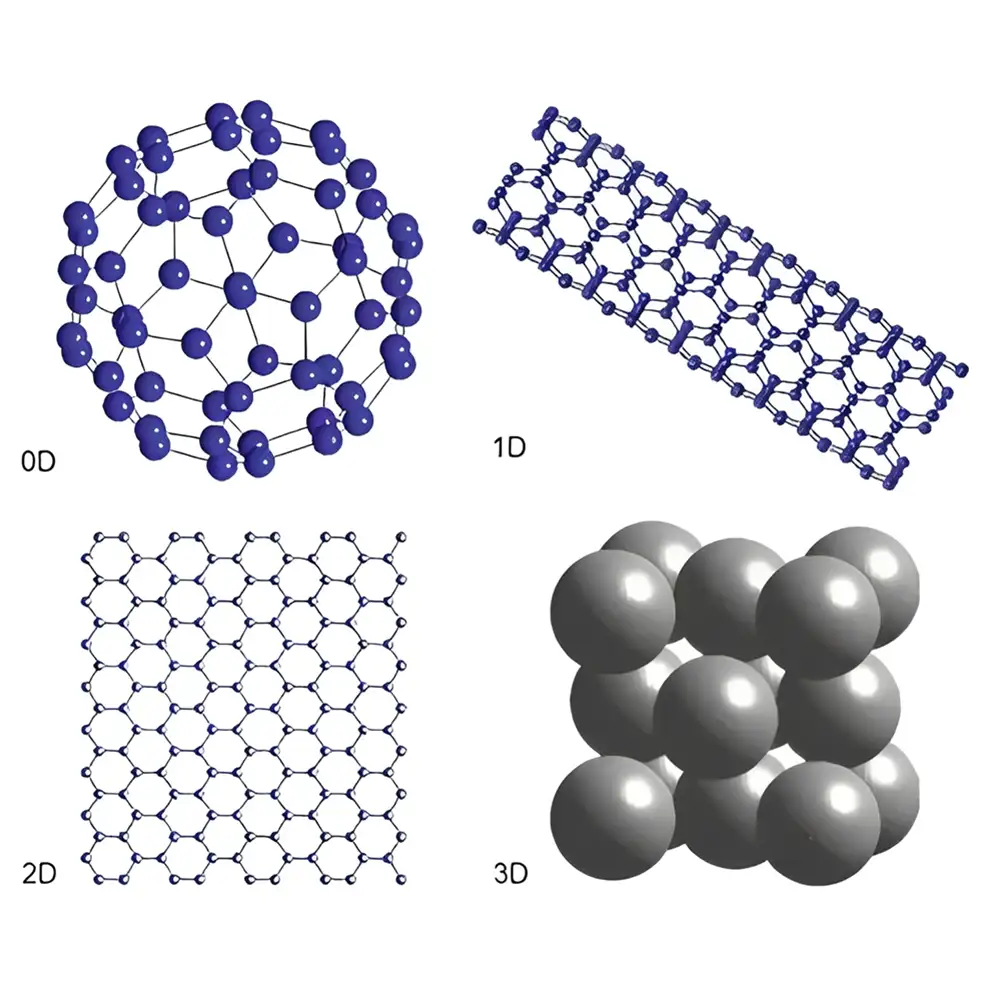
نانوپزشکی، شاخهای نوین از علوم پزشکی است که با استفاده از نانوذرات، نانوساختارها و فناوریهای نانومتری، امکان پیشرفت در تشخیص، درمان و پایش بیماریها را فراهم میکند. در نانوپزشکی، اندازه ذرات معمولاً بین ۱ تا ۱۰۰ نانومتر است و در این مقیاس، مواد ویژگیهای منحصر به فردی پیدا میکنند که در ابعاد میکروسکوپی و ماکروسکوپی مشاهده نمیشود. این ویژگیها شامل افزایش سطح فعال، تغییرات فیزیکوشیمیایی، قابلیت هدفگیری سلولی و نفوذپذیری بالا هستند.
در زمینه سرطان، نانوپزشکی به دلیل ویژگیهای منحصر به فرد نانوذرات، امکان توسعه داروهای هدفمند، کاهش سمیت دارویی و افزایش اثر درمانی را فراهم میکند. این رویکرد، تحولی در درمان سرطان ایجاد کرده است، زیرا میتواند محدودیتهای درمانهای سنتی مانند شیمیدرمانی و پرتو درمانی را برطرف کند.
ویژگیهای کلیدی نانوذرات در درمان سرطان
هدفگیری دقیق سلولهای سرطانی
یکی از بزرگترین چالشهای درمان سرطان، آسیب غیرهدفمند به بافتهای سالم است. نانوذرات به دلیل ابعاد کوچک و قابلیت سطح فعال بالا، میتوانند داروها را مستقیماً به سلولهای سرطانی منتقل کنند. این هدفگیری میتواند به دو صورت انجام شود:
-
هدفگیری غیرفعال : (Passive Targeting) استفاده از اثر نفوذپذیری و احتباس تومور (EPR effect) که باعث تجمع خودبهخود نانوذرات در بافت تومور میشود.
-
هدفگیری فعال : (Active Targeting) اتصال لیگاندها، آنتیبادیها یا پپتیدها به سطح نانوذرات برای شناسایی و اتصال به گیرندههای خاص سلولهای سرطانی.
افزایش حلالیت و پایداری داروها
بسیاری از داروهای شیمیدرمانی دارای حلالیت کم و نیمهعمر کوتاه در بدن هستند. نانوذرات میتوانند این داروها را در خود جای دهند و آنها را در محیط بیولوژیکی پایدار نگه دارند. این ویژگی باعث افزایش کارایی دارو، کاهش دفعات مصرف و بهبود پاسخ درمانی میشود.
آزادسازی کنترلشده دارو
نانوذرات میتوانند طراحی شوند تا داروها را به صورت پاسخگو به محرکها (Stimuli-responsive) آزاد کنند. این محرکها شامل pH، دما، آنزیمها، نور و میدان مغناطیسی هستند. این قابلیت به نانوذرات اجازه میدهد تا دارو را دقیقاً در محیط تومور آزاد کنند و از آسیب به بافت سالم جلوگیری کنند.
تشخیص و پایش همزمان (Theranostics)
نانوپزشکی این امکان را فراهم میکند که درمان و تشخیص همزمان انجام شود. نانوذرات میتوانند به گونهای طراحی شوند که هم دارو را حمل کنند و هم سیگنالهای تصویربرداری MRI، PET یا فلورسانس را تولید کنند. این ویژگی به پزشکان امکان میدهد تا پیشرفت تومور را مشاهده کرده و پاسخ درمانی را به صورت زنده پایش کنند.
انواع نانوذرات و کاربردهای آنها در سرطان
نانوذرات لیپیدی
لیپوزومها و نانوذرات لیپیدی جامد، به دلیل سازگاری زیستی بالا و قابلیت حمل داروهای آبدوست و چربیدوست، در درمان سرطان بسیار مورد استفاده قرار میگیرند. لیپوزومهای PEGylated نمونهای از نانوذراتی هستند که با افزایش نیمهعمر دارو در گردش خون، اثر درمانی را بهبود میبخشند.
نانوذرات پلیمرها
نانوذرات ساخته شده از پلیمرهای طبیعی و سنتتیک مانند پلی لاکتیک-کو-گلیکولیک اسید (PLGA)، امکان حمل داروهای شیمیدرمانی، RNA و DNA درمانی را فراهم میکنند. این نانوذرات میتوانند داروها را به صورت آزادسازی کنترلشده و هدفمند به سلولهای سرطانی منتقل کنند و از تجزیه زودهنگام دارو جلوگیری کنند.
نانوذرات فلزی
نانوذرات فلزی مانند نانوذرات طلا و نقره به دلیل خواص منحصر به فرد الکتریکی و نوری، علاوه بر حمل دارو، در تصویربرداری و درمان فتوترمال نیز کاربرد دارند. نانوذرات طلا میتوانند با تابش نور مادون قرمز، حرارت تولید کرده و سلولهای سرطانی را تخریب کنند، بدون آنکه بافت سالم آسیب ببیند.
نانوذرات هیبریدی و چندکاره
سیستمهای نانوذرهای چندکاره قادر به ترکیب شیمیدرمانی، فتوترمال، تصویربرداری و رهایش کنترلشده دارو هستند. این نانوذرات، پیشرفتهترین نسل نانوپزشکی برای درمان سرطان محسوب میشوند و در مطالعات بالینی نویدبخش نتایج موفق بودهاند.
مزایای نانوپزشکی نسبت به درمانهای سنتی
-
کاهش سمیت سیستمیک : با هدایت هدفمند داروها، بافتهای سالم کمتر تحت تأثیر دارو قرار میگیرند.
-
افزایش کارایی درمان : تجمع نانوذرات در تومور باعث افزایش اثر دارویی و کاهش مقاومت سلولی میشود.
-
انعطافپذیری در طراحی دارو : امکان ترکیب چندین نوع درمان در یک نانوذره.
-
پایش زنده درمان : استفاده از نانوذرات برای تصویربرداری و پایش پاسخ تومور در زمان واقعی.
-
کاهش دفعات تجویز دارو : رهایش کنترلشده دارو باعث کاهش تعداد دفعات مصرف و بهبود کیفیت زندگی بیماران میشود.
نمونههای کاربردی نانوپزشکی در سرطان
-
سرطان پستان: استفاده از لیپوزومهای دارویی و نانوذرات پلیمری برای رهایش هدفمند داروهایی مانند دوکسوروبیسین و پکلیتاکسل.
-
سرطان ریه : نانوذرات مغناطیسی برای رساندن داروهای شیمیدرمانی و پایش تصویربرداری.
-
سلولهای بنیادی سرطانی : نانوذرات هدفمند برای تخریب سلولهای سرطانی مقاوم و جلوگیری از بازگشت تومور.
-
ترکیب با ایمونوتراپی : نانوذرات قادر به انتقال آنتیبادیها و مولکولهای ایمنی به محیط تومور و تقویت پاسخ ایمنی هستند.
چالشها و محدودیتهای نانوپزشکی در درمان سرطان
با وجود تمام مزایا، نانوپزشکی هنوز با چالشهایی مواجه است:
-
ایمنی طولانیمدت و سمیت نانوذرات : برخی نانوذرات ممکن است در ارگانهای حیاتی تجمع کرده و اثرات جانبی طولانیمدت ایجاد کنند.
-
تولید انبوه و استانداردسازی: ساخت نانوذرات با کیفیت و یکنواخت در مقیاس صنعتی دشوار است.
-
مقررات و تاییدیههای بالینی : روند تایید FDA و دیگر سازمانهای نظارتی زمانبر است و محدودیتهای قانونی وجود دارد.
با این حال، پژوهشهای اخیر و پیشرفتهای فناوری در حال کاهش این موانع هستند و مسیر استفاده گسترده بالینی نانوپزشکی در درمان سرطان هموارتر شده است.
نانوپزشکی به دلیل هدفگیری دقیق، کاهش سمیت، آزادسازی کنترلشده دارو و امکان ترکیب درمان و تشخیص، انقلابی در درمان سرطان ایجاد کرده است. انواع مختلف نانوذرات لیپیدی، پلیمری، فلزی و هیبریدی امکان طراحی درمانهای پیشرفته و چندکاره را فراهم کردهاند. این فناوری نوظهور نه تنها افزایش اثربخشی درمان را ممکن میکند، بلکه کیفیت زندگی بیماران را بهبود میبخشد و امید به درمان سرطانهای مقاوم را افزایش میدهد.
مطالعات بالینی و تحقیقاتی نشان میدهند که نانوپزشکی میتواند در سرطانهای پستان، ریه، کبد، مغز و سلولهای بنیادی سرطانی نقش مؤثری داشته باشد و به عنوان یک رویکرد مکمل یا جایگزین برای درمانهای سنتی استفاده شود. در بخشهای بعدی، به انواع نانوذرات و سیستمهای دارورسانی، مکانیسمهای هدفگیری و کاربردهای بالینی دقیقتر خواهیم پرداخت.
انواع نانوذرات و سیستمهای دارورسانی
نانوذرات لیپیدی
لیپوزومها
لیپوزومها، اولین و یکی از پرکاربردترین سیستمهای نانوذرهای در درمان سرطان هستند. این ساختارها از یک دو لایه لیپیدی تشکیل شدهاند که داروهای آبدوست را در هسته آبی و داروهای چربیدوست را در لایه لیپیدی خود جای میدهند. مزیت اصلی لیپوزومها، قابلیت زیستسازگاری بالا و کاهش سمیت سیستمیک داروها است.
-
کاربرد بالینی: لیپوزومهای PEGylated برای داروی دوکسوروبیسین در درمان سرطان پستان و تخمدان استفاده میشوند و نشان دادهاند که اثرات جانبی قلبی کمتر و کارایی دارویی بالاتری نسبت به فرم آزاد دارو دارند.
-
مزایا : افزایش نیمهعمر دارو در گردش خون، کاهش دفع سریع و بهبود هدفگیری تومور.
-
محدودیتها : پایداری محدود در شرایط فیزیولوژیکی و امکان تجمع در اندامهای غیرهدف.
نانوذرات لیپیدی جامد (SLN)
این نوع نانوذرات از لیپیدهای جامد ساخته شده و داروها را به صورت پایدار در خود نگه میدارند. SLNها قابلیت آزادسازی کنترلشده دارو و انتقال داروهای حساس به محیط را فراهم میکنند.
-
کاربردها : انتقال داروهای شیمیدرمانی و مولکولهای ژنتیکی به تومورها.
-
مزایا: پایداری بالا، زیستسازگاری و قابلیت بارگیری داروی زیاد.
-
محدودیتها : محدودیت در انتخاب نوع لیپید و مشکلات تولید در مقیاس صنعتی.
نانوذرات پلیمری
نانوساختارهای پلیمری
نانوذرات پلیمری، از پلیمرهای طبیعی یا سنتتیک مانند PLGA، پلیلاکتیک و پلیکاپرولاکتون ساخته میشوند و قابلیت حمل داروهای شیمیدرمانی، RNA درمانی و DNA درمانی را دارند.
-
مزیت کلیدی : امکان طراحی نانوذرات با آزادسازی کنترلشده، هدفمند و چندکاره.
-
کاربرد بالینی: استفاده از PLGA برای داروی paclitaxel در درمان سرطان پستان و ریه، نشاندهنده افزایش اثر دارو و کاهش سمیت سیستمیک است.
-
محدودیتها : تجزیه پلیمرها در محیط زیستی و احتمال واکنش ایمنی با بدن میزبان.
دندریمرها
دندریمرها، پلیمرهای شاخهدار و منظم هستند که قابلیت حمل مولکولهای درمانی متعدد به صورت همزمان را دارند. این ساختارها به دلیل سطح زیاد و گروههای فعال متعدد، میتوانند داروها و مولکولهای هدفگیرنده را به صورت همزمان حمل کنند.
-
مزایا : هدفگیری دقیق، بارگیری داروی بالا و قابلیت اتصال به لیگاندهای سلولی.
-
کاربردها : استفاده برای حمل داروهای ضدسرطان و مولکولهای ایمونوتراپی به سلولهای سرطانی.
-
محدودیتها : پیچیدگی تولید و هزینه بالای ساخت.
نانوذرات فلزی
نانوذرات طلا (AuNPs)
نانوذرات طلا به دلیل ویژگیهای اپتیکی و فتوترمال، یکی از پرکاربردترین سیستمها در نانوپزشکی سرطان هستند. این نانوذرات میتوانند داروها را حمل کنند و با تابش نور مادون قرمز، حرارت تولید کرده و سلولهای سرطانی را تخریب کنند.
-
مزایا: هدفگیری سلولهای سرطانی، استفاده در تصویربرداری و درمان فتوترمال.
-
کاربردها: درمان سرطان پستان و ریه با ترکیب دارو و فتوترمال تراپی.
-
محدودیتها : امکان تجمع در کبد و طحال، نیاز به اصلاح سطحی برای کاهش سمیت.
نانوذرات نقره و آهن
این نانوذرات علاوه بر حمل دارو، میتوانند سیگنالهای تصویربرداری MRI یا CT را تقویت کنند و به عنوان ناقل مولکولهای درمانی و تشخیصی عمل کنند.
-
مزایا: چندکاره بودن، افزایش دقت تشخیص و درمان ترکیبی.
-
محدودیتها : سمیت بالقوه و نیاز به پوشش زیستسازگار.
نانوذرات هیبریدی و چندکاره
سیستمهای چندکاره
این نانوذرات قادر به ترکیب چندین عملکرد هستند؛ به عنوان مثال، یک نانوذره میتواند هم دارو حمل کند، هم به سلولهای هدف متصل شود، هم در تصویربرداری شرکت کند و هم آزادسازی کنترلشده داشته باشد.
-
نمونهها : نانوذرات لیپید-پلیمری، نانوذرات فلزی-پلیمری.
-
کاربردها : درمان سرطانهای مقاوم، پایش زنده درمان و ترکیب شیمیدرمانی با ایمونوتراپی.
-
مزایا: افزایش اثر درمانی، کاهش مقاومت سلولی و امکان رصد پاسخ درمانی در زمان واقعی.
-
محدودیتها : پیچیدگی طراحی، هزینه بالا و چالشهای تولید صنعتی.
سیستمهای دارورسانی پاسخگو به محرکها
محرکهای داخلی
نانوذرات میتوانند به pH پایین تومور، آنزیمهای خاص و شرایط اکسیداتیو پاسخ دهند و دارو را فقط در محیط تومور آزاد کنند. این ویژگی باعث میشود که دارو به صورت هدفمند و با حداقل آسیب به بافت سالم عمل کند.
محرکهای خارجی
نانوذرات میتوانند به نور، میدان مغناطیسی، دما و فراصوت پاسخ دهند. به عنوان مثال، نانوذرات طلا با تابش نور مادون قرمز نزدیک، حرارت تولید میکنند و سلولهای سرطانی را تخریب میکنند، در حالی که بافت سالم آسیب نمیبیند.
مزایای دارورسانی پاسخگو به محرکها
-
آزادسازی کنترلشده دارو در محل تومور
-
کاهش دوز مصرفی و اثرات جانبی
-
افزایش کارایی درمان و کنترل بهتر روند بیماری
ترکیب انواع نانوذرات برای کاربردهای چندگانه
در بسیاری از تحقیقات جدید، ترکیب لیپیدها، پلیمرها و فلزات در یک سیستم نانوذرهای نشان داده است که میتوان دارو، عامل تشخیصی و سیگنال تصویربرداری را همزمان به سلولهای سرطانی رساند. این سیستمهای چندکاره، به عنوان نسل جدید نانوپزشکی در درمان سرطان شناخته میشوند.
مزایای استفاده از نانوذرات در درمان سرطان
-
هدفگیری دقیق و کاهش آسیب به بافت سالم
-
افزایش پایداری و نیمهعمر داروها
-
آزادسازی کنترلشده و پاسخگو به محرکها
-
امکان ترکیب درمان و تشخیص در یک سیستم (Theranostics)
-
بهبود کیفیت زندگی بیماران و کاهش دفعات تجویز دارو
چالشهای مربوط به سیستمهای دارورسانی نانوذرهای
با وجود مزایای فراوان، چالشهایی در مسیر بالینی وجود دارد:
-
ایمنی طولانیمدت و سمیت نانوذرات
-
پیچیدگی تولید و هزینه بالای سیستمهای چندکاره
-
تغییرات در توزیع زیستی نانوذرات و عدم پیشبینی کامل اثرات
-
نیاز به اصلاح سطح نانوذرات برای کاهش واکنش ایمنی و تجمع غیرهدفمند
با این حال، پیشرفتهای اخیر در طراحی و مهندسی نانوذرات باعث شده است که بسیاری از این چالشها کاهش یابند و مسیر استفاده بالینی آنها در درمان سرطان هموارتر شود.
نانوذرات لیپیدی، پلیمری، فلزی و هیبریدی، هر یک دارای مزایا و محدودیتهای خاص خود هستند، اما تمامی آنها با هدف افزایش اثر درمانی، کاهش سمیت و امکان ترکیب درمان و تشخیص طراحی شدهاند. استفاده از سیستمهای پاسخگو به محرکها و سیستمهای چندکاره، نویدبخش تحول در درمان سرطانهای مقاوم و پایش زنده پاسخ درمانی است.
مطالعات بالینی نشان دادهاند که نانوذرات قادرند داروهای شیمیدرمانی، مولکولهای ژنتیکی و عوامل ایمونوتراپی را به صورت هدفمند به سلولهای سرطانی منتقل کنند و کیفیت درمان و زندگی بیماران را بهبود بخشند. در بخش بعدی، به مکانیزمهای هدفگیری سرطان با نانوپزشکی خواهیم پرداخت و جزئیات فنی و کاربردی آن را بررسی خواهیم کرد.
مکانیزمهای هدفگیری سرطان با نانوپزشکی
هدفگیری سرطان با نانوپزشکی
یکی از مزایای کلیدی نانوپزشکی در درمان سرطان، توانایی نانوذرات در شناسایی و حمل داروها به سلولهای سرطانی به صورت هدفمند است. هدفگیری دقیق باعث افزایش اثر دارویی، کاهش دوز مصرفی و کاهش عوارض جانبی دارو میشود. نانوذرات میتوانند داروها و مولکولهای درمانی را از طریق مکانیزمهای هدفگیری غیرفعال و فعال به تومور منتقل کنند.
هدفگیری غیرفعال
اثر نفوذپذیری و احتباس تومور (EPR Effect)
یکی از شناختهشدهترین مکانیزمهای هدفگیری غیرفعال، اثر EPR است. در تومورها، رگهای خونی غیرطبیعی و متخلخل ایجاد میشوند که باعث میشود نانوذرات به طور طبیعی در محل تومور تجمع یابند. این فرآیند باعث میشود که داروها به صورت متمرکز در بافت سرطانی باقی بمانند و از پخش گسترده در بدن جلوگیری شود.
ویژگیهای نانوذرات برای هدفگیری غیرفعال
-
اندازه مناسب (۱۰–۲۰۰ نانومتر): اجازه عبور از رگهای خونی غیرطبیعی تومور.
-
سطح فعال و پوشش زیستسازگار : کاهش شناسایی توسط سیستم ایمنی و افزایش نیمهعمر در گردش خون.
-
بار دارویی کافی : امکان حمل داروهای متعدد برای افزایش اثر درمانی.
هدفگیری غیرفعال به تنهایی میتواند تجمع دارو در تومور را افزایش دهد، اما معمولاً برای افزایش دقت و جلوگیری از اثرات جانبی نیاز به ترکیب با هدفگیری فعال دارد.
هدفگیری فعال
استفاده از لیگاندها
در هدفگیری فعال، نانوذرات به مولکولهای خاصی به نام لیگاندها متصل میشوند که قادرند گیرندههای سلولهای سرطانی را شناسایی کنند. این لیگاندها میتوانند شامل آنتیبادیها، پپتیدها، ویتامینها یا مولکولهای کوچکتر باشند.
-
آنتیبادیها : (Antibodies) اتصال به گیرندههای خاص سلول سرطانی، مانند HER2 در سرطان پستان.
-
پپتیدها : (Peptides) اتصال به گیرندههای overexpressed در تومور، مانند RGD peptides که به integrins متصل میشوند.
-
ویتامینها و مولکولهای کوچک : مانند فولیک اسید که به گیرندههای فولیک اسید در تومورهای خاص متصل میشوند.
مزایای هدفگیری فعال
-
افزایش دقت دارو در محل تومور
-
کاهش تجمع دارو در بافتهای سالم
-
امکان کنترل آزادسازی دارو به صورت موضعی
مکانیزمهای سلولی هدفگیری فعال
نانوذرات میتوانند از طریق فرآیندهای مختلف وارد سلولهای سرطانی شوند:
-
اندوسیتوز گیرندهدار : (Receptor-mediated endocytosis) نانوذرات با اتصال به گیرندهها وارد سلول میشوند.
-
فیوژن با غشا سلول : (Membrane fusion) نانوذرات لیپیدی میتوانند با غشا سلول ادغام شده و دارو را مستقیماً وارد سیتوپلاسم کنند.
-
انتقال فعال از طریق کانالهای سلولی : برخی نانوذرات میتوانند از کانالهای یونی یا پمپهای دارویی عبور کنند.
نانوذرات پاسخگو به محرکها در هدفگیری
یکی از پیشرفتهترین روشهای هدفگیری، استفاده از نانوذرات پاسخگو به محرکها (Stimuli-responsive nanoparticles) است. این نانوذرات میتوانند به محرکهای داخلی یا خارجی پاسخ دهند و دارو را تنها در محل تومور آزاد کنند.
محرکهای داخلی:
-
pH پایین تومور: نانوذرات حساس به pH، دارو را در محیط اسیدی تومور آزاد میکنند.
-
آنزیمهای خاص تومور: برخی نانوذرات در حضور آنزیمهای overexpressed در تومور تجزیه شده و دارو را آزاد میکنند.
-
شرایط اکسیداتیو : تولید دارو با افزایش ROS در سلولهای سرطانی.
محرکهای خارجی:
-
نور : نانوذرات فتوترمال با تابش نور مادون قرمز نزدیک حرارت تولید کرده و سلولهای سرطانی را تخریب میکنند.
-
میدان مغناطیسی : نانوذرات مغناطیسی میتوانند به صورت متمرکز به محل تومور هدایت شوند.
-
فراصوت و دما: افزایش نفوذ و آزادسازی دارو با استفاده از امواج فراصوت یا حرارت موضعی.
ترکیب هدفگیری فعال و غیرفعال
برای افزایش دقت درمان، بسیاری از نانوذرات مدرن ترکیبی از هدفگیری فعال و غیرفعال را استفاده میکنند. در این حالت:
-
هدفگیری غیرفعال، نانوذرات را در محل تومور تجمع میدهد.
-
هدفگیری فعال، ورود دقیق به سلولهای سرطانی و رهایش دارو را تضمین میکند.
این ترکیب باعث میشود که اثر درمانی به حداکثر و عوارض جانبی به حداقل برسد.
مثالهای بالینی و تحقیقاتی از هدفگیری نانوپزشکی
-
سرطان پستان : نانوذرات PEGylated متصل به آنتیبادی HER2، داروی دوکسوروبیسین را مستقیماً به سلولهای HER2 مثبت میرسانند و نتایج بالینی کاهش عوارض قلبی را نشان دادهاند.
-
سرطان ریه : نانوذرات مغناطیسی برای حمل داروهای شیمیدرمانی و تصویربرداری MRI، تجمع دارو در تومور را افزایش داده و درمان ترکیبی را امکانپذیر میکنند.
-
سلولهای بنیادی سرطانی : استفاده از نانوذرات هدفمند برای تخریب سلولهای مقاوم به درمان و جلوگیری از بازگشت تومور.
-
ترکیب با ایمونوتراپی : نانوذرات میتوانند داروهای ایمونومدولاتور را به محیط تومور منتقل کنند و پاسخ ایمنی بدن به سلولهای سرطانی را تقویت کنند.
مزایای مکانیزمهای هدفگیری با نانوپزشکی
-
افزایش دقت درمان و کاهش اثرات جانبی : با رساندن دارو فقط به سلولهای سرطانی.
-
کاهش دوز مصرفی دارو : به دلیل تجمع موثر دارو در محل هدف.
-
امکان طراحی داروهای چندکاره : ترکیب دارو، تصویرسازی و پاسخ به محرکها.
-
بهبود کیفیت زندگی بیماران : کاهش عوارض سیستمیک و افزایش اثربخشی درمان.
چالشها و محدودیتها
با وجود پیشرفتهای بزرگ، هدفگیری سرطان با نانوپزشکی با چالشهایی همراه است:
-
تفاوتهای فردی در ساختار تومور : اثر EPR در همه بیماران یکسان نیست.
-
ایمنی طولانیمدت : برخی نانوذرات ممکن است در ارگانهای حیاتی تجمع کنند.
-
پیچیدگی طراحی: ترکیب هدفگیری فعال و غیرفعال و پاسخ به محرکها نیازمند فناوری پیشرفته و هزینه بالا است.
مکانیزمهای هدفگیری سرطان با نانوپزشکی شامل هدفگیری غیرفعال با اثر EPR، هدفگیری فعال با لیگاندها و پپتیدها و نانوذرات پاسخگو به محرکها است. ترکیب این مکانیزمها، افزایش اثر دارویی، کاهش سمیت و بهبود پاسخ درمانی را ممکن میکند. نمونههای بالینی و تحقیقاتی نشان دادهاند که این روشها در سرطان پستان، ریه، سلولهای بنیادی سرطانی و ترکیب با ایمونوتراپی بسیار مؤثر هستند.
نانوپزشکی ترانستیک و تصویربرداری همزمان
مفهوم نانوپزشکی ترانستیک (Theranostic Nanomedicine)
نانوپزشکی ترانستیک، شاخهای از نانوپزشکی است که تشخیص و درمان بیماریها، به ویژه سرطان، را به صورت همزمان ترکیب میکند. واژه “Theranostic” ترکیبی از دو کلمه Therapeutic (درمانی( و Diagnostic )تشخیصی) است و هدف اصلی آن افزایش دقت درمان، کاهش سمیت و امکان پایش زنده پاسخ درمانی است.
در سیستمهای ترانستیک، نانوذرات طراحی میشوند تا هم داروهای ضدسرطان را حمل کنند و هم سیگنالهای تصویربرداری پزشکی مانند MRI، PET، CT یا فلورسانس را تولید کنند. این ترکیب امکان تصویربرداری مستقیم تومور و مشاهده توزیع دارو در بدن را فراهم میکند.
انواع نانوذرات ترانستیک
نانوذرات لیپیدی ترانستیک
لیپوزومهای ترانستیک، داروهای شیمیدرمانی را در هسته یا لایه لیپیدی خود حمل میکنند و میتوانند با عامل تصویربرداری مانند فلوروفور یا نانوذرات مغناطیسی ترکیب شوند.
-
مزایا : زیستسازگاری بالا، هدفگیری مستقیم تومور و امکان تصویربرداری همزمان.
-
مثال بالینی : لیپوزومهای PEGylated حاوی دوکسوروبیسین و نانوذرات مغناطیسی برای درمان سرطان پستان و تصویربرداری .MRI
نانوذرات پلیمری ترانستیک
نانوذرات پلیمری، به ویژه PLGA و پلیلاکتیک، قابلیت حمل همزمان دارو و مولکولهای تصویربرداری را دارند. این سیستمها میتوانند به صورت پاسخگو به محرکها( pH یا آنزیمها) عمل کنند و دارو را دقیقاً در محل تومور آزاد کنند.
-
مزایا: آزادسازی کنترلشده، افزایش اثر دارو و کاهش عوارض جانبی.
-
کاربردها : تصویربرداری همزمان PET/MRI و انتقال داروهای شیمیدرمانی یا RNA درمانی به سلولهای سرطانی.
نانوذرات فلزی ترانستیک
نانوذرات فلزی، به ویژه طلا، نقره و اکسید آهن، به دلیل خواص اپتیکی، فتوترمال و مغناطیسی برای ترانستیک استفاده میشوند.
-
مزایا : قابلیت ترکیب درمان فتوترمال، شیمیدرمانی و تصویربرداری MRI یا CT در یک سیستم واحد.
-
مثالها : نانوذرات طلا حاوی داروهای ضدسرطان که با نور مادون قرمز فعال میشوند و همزمان امکان تصویربرداری فلورسانس را دارند.
نانوذرات چندکاره (Multifunctional Nanoparticles)
این نانوذرات قادرند چندین عملکرد درمانی و تشخیصی را ترکیب کنند. برای مثال، یک نانوذره میتواند هم داروی شیمیدرمانی حمل کند، هم به سلولهای سرطانی متصل شود، هم تصویر MRI تولید کند و هم پاسخ به محرک pH داشته باشد.
-
مزایا : افزایش اثربخشی درمان، کاهش مقاومت دارویی و امکان پایش زنده.
-
محدودیتها : پیچیدگی طراحی، هزینه بالا و چالشهای تولید صنعتی.
سیستمهای تصویربرداری همزمان با درمان
نانوپزشکی ترانستیک با استفاده از سیستمهای تصویربرداری همزمان امکان پایش دقیق دارو در بدن و پاسخ تومور به درمان را فراهم میکند. این سیستمها شامل موارد زیر هستند:
MRI (تصویربرداری رزونانس مغناطیسی(
-
نانوذرات مغناطیسی مانند Fe₃O₄ میتوانند سیگنال MRI تولید کنند و همزمان دارو حمل کنند.
-
مزیت : تصویربرداری با وضوح بالا و بدون تابش یونیزان.
PET (تصویربرداری پوزیترون)
-
نانوذرات ترانستیک میتوانند ایزوتوپهای رادیواکتیو را حمل کنند و تجمع دارو در تومور را با PET پایش کنند.
-
مزیت : امکان تشخیص دقیق توزیع دارو در بدن و پایش زنده پاسخ درمانی.
CT (توموگرافی کامپیوتری(
-
نانوذرات فلزی مانند طلا میتوانند کنتراست CT را افزایش دهند و همزمان دارو آزاد کنند.
-
مزیت : تصویربرداری دقیق از ساختار تومور و پایش درمان.
فلورسانس و فوتوترمال
-
نانوذرات حاوی فلوروفورها یا فتوترمالها میتوانند تصویربرداری زنده و تخریب هدفمند سلولهای سرطانی را همزمان انجام دهند.
-
مزیت : امکان ترکیب درمان و تشخیص در یک سیستم واحد، کاهش آسیب به بافت سالم و کنترل دقیق دارو.
مزایای نانوپزشکی ترانستیک
-
پایش زنده توزیع دارو : پزشکان میتوانند مسیر دارو را مشاهده کرده و بهینهسازی درمان انجام دهند.
-
ترکیب درمان و تشخیص: کاهش نیاز به آزمونهای تشخیصی جداگانه و افزایش سرعت تصمیمگیری بالینی.
-
هدفگیری دقیق سلولهای سرطانی: کاهش سمیت سیستمیک و افزایش اثر دارویی.
-
امکان درمان شخصیسازیشده : با پایش پاسخ درمانی، دوز و زمانبندی دارو میتواند متناسب با بیمار تنظیم شود.
مثالهای بالینی و تحقیقاتی از نانوپزشکی ترانستیک
-
سرطان پستان : لیپوزومهای PEGylated حاوی دوکسوروبیسین و نانوذرات مغناطیسی برای MRI، نشان دادهاند که تجمع دارو در تومور افزایش یافته و عوارض جانبی کاهش یافته است.
-
سرطان مغز : نانوذرات مغناطیسی ترانستیک قادرند دارو را از سد خونی-مغزی عبور داده و تصویربرداری MRI را همزمان ارائه دهند.
-
سرطان ریه : نانوذرات چندکاره که دارو و فتوترمال را ترکیب میکنند، امکان تصویربرداری PET/CT و تخریب سلولهای سرطانی با دقت بالا را فراهم کردهاند.
-
ترکیب با ایمونوتراپی : نانوذرات حاوی داروهای ایمونومدولاتور و عامل تصویربرداری، امکان تقویت پاسخ ایمنی و پایش مستقیم تجمع دارو در تومور را دارند.
چالشها و محدودیتهای نانوپزشکی ترانستیک
با وجود مزایای فراوان، نانوپزشکی ترانستیک با چالشهایی مواجه است:
-
پیچیدگی طراحی و تولید : ترکیب دارو، مولکول تصویربرداری و هدفگیری فعال نیازمند فناوری پیشرفته است.
-
هزینه بالا: تولید نانوذرات چندکاره و ترانستیک هزینهبر و زمانبر است.
-
ایمنی طولانیمدت : برخی نانوذرات ممکن است در ارگانهای حیاتی تجمع کنند و اثرات جانبی طولانی ایجاد کنند.
-
تاییدیه بالینی : روند تصویب FDA و سازمانهای نظارتی برای نانوپزشکی ترانستیک هنوز محدود و پیچیده است.
جمعبندی بخش نانوپزشکی ترانستیک و تصویربرداری همزمان
نانوپزشکی ترانستیک، با ترکیب تشخیص و درمان همزمان، انقلابی در درمان سرطان ایجاد کرده است. استفاده از نانوذرات لیپیدی، پلیمری و فلزی ترانستیک، امکان تصویربرداری زنده، ردیابی دارو و هدفگیری دقیق سلولهای سرطانی را فراهم میکند. نمونههای بالینی نشان دادهاند که این فناوری میتواند اثر درمانی را افزایش داده و عوارض جانبی دارو را کاهش دهد.
با پیشرفتهای اخیر، سیستمهای ترانستیک چندکاره و پاسخگو به محرکها، نویدبخش درمانهای شخصیسازیشده و پایش زنده پاسخ تومور هستند. در بخش بعدی، میتوانیم به کاربرد نانوپزشکی در انواع سرطانها و مثالهای بالینی موفق بپردازیم.
نانوپزشکی پاسخگو به محرکها (Stimuli-responsive nanomedicine)
مفهوم نانوپزشکی پاسخگو به محرکها
نانوپزشکی پاسخگو به محرکها، شاخهای پیشرفته از نانوپزشکی است که داروها را تنها در حضور محرک خاصی آزاد میکند. این رویکرد باعث میشود که اثر دارو بر سلولهای سرطانی افزایش یافته و اثرات جانبی بر بافت سالم به حداقل برسد. سیستمهای پاسخگو به محرکها به دو دسته اصلی تقسیم میشوند: محرکهای داخلی (Internal stimuli) و محرکهای خارجی (External stimuli).
نانوذرات پاسخگو به محرکهای داخلی
محرکهای داخلی، شرایط بیولوژیکی خاص محیط تومور یا سلولهای سرطانی هستند که نانوذرات را فعال میکنند. این شرایط معمولاً در بافت سرطانی بافت سالم متفاوت است و شامل موارد زیر میشوند:
pH پایین تومور
-
محیط تومور معمولاً اسیدیتر از بافت سالم است pH) حدود ۶٫۵–۶٫۸ در مقایسه با pH ۷٫۴ خون.(
-
نانوذرات حساس به pH میتوانند در محیط اسیدی تومور دارو را آزاد کنند و در بافت سالم باقی بمانند.
-
مثال: نانوذرات پلیمری PLGA با پوشش حساس به pH که دوکسوروبیسین را فقط در تومور رها میکنند.
آنزیمهای خاص تومور
-
برخی آنزیمها مانند ماتریکس متالوپروتئینازها (MMPs) در تومور overexpress میشوند.
-
نانوذرات طراحی شده برای پاسخ به این آنزیمها، در حضور MMPها تجزیه شده و دارو را آزاد میکنند.
-
مزیت: آزادسازی بسیار هدفمند و کاهش سمیت سیستمیک.
شرایط اکسیداتیو و ROS (Reactive Oxygen Species)
-
سلولهای سرطانی سطح ROS بالاتری نسبت به سلولهای سالم دارند.
-
نانوذرات پاسخگو به ROS میتوانند دارو را فقط در محیطهای با سطح اکسیداتیو بالا آزاد کنند.
-
کاربردها: درمان سرطانهای مقاوم به دارو و افزایش اثرات شیمیدرمانی.
گرادیان گلوکز و متابولیسم تومور
-
سلولهای سرطانی متابولیسم بالایی دارند و گلوکز بیشتری مصرف میکنند.
-
برخی نانوذرات میتوانند با تشخیص تغییرات متابولیکی سلولهای سرطانی، دارو را آزاد کنند.
نانوذرات پاسخگو به محرکهای خارجی
محرکهای خارجی توسط پزشک یا فناوری خارج از بدن اعمال میشوند و به نانوذرات دستور آزادسازی دارو را میدهند. این رویکرد امکان کنترل زمان و محل آزادسازی دارو را به طور دقیق فراهم میکند.
نور (Light-responsive nanoparticles)
-
نانوذرات فتوترمال یا فتوترانستیک میتوانند با نور مادون قرمز نزدیک (NIR) فعال شوند.
-
کاربرد: ایجاد حرارت موضعی برای تخریب سلولهای سرطانی و آزادسازی دارو.
-
مثال: نانوذرات طلا حاوی داروهای شیمیدرمانی که با نور NIR فعال میشوند و همزمان امکان تصویربرداری فلورسانس را فراهم میکنند.
میدان مغناطیسی (Magnetic-responsive nanoparticles)
-
نانوذرات مغناطیسی مانند Fe₃O₄ میتوانند با استفاده از میدان مغناطیسی خارجی به محل تومور هدایت شوند.
-
کاربرد: افزایش تجمع دارو در تومور و کاهش اثرات جانبی بر بافت سالم.
فراصوت و امواج صوتی (Ultrasound-responsive nanoparticles)
-
نانوذرات میتوانند با امواج فراصوت فعال شوند و دارو را در محل هدف آزاد کنند.
-
مزیت: امکان نفوذ به بافتهای عمیق و کنترل دقیق دارو.
حرارت (Thermo-responsive nanoparticles)
-
برخی نانوذرات در دماهای بالاتر از دمای بدن شروع به آزادسازی دارو میکنند.
-
کاربرد: ترکیب با درمان فتوترمال و افزایش اثر درمانی در محل تومور.
سیستمهای چندمحرکه (Multi-stimuli-responsive nanoparticles)
برای افزایش دقت و انعطافپذیری، بسیاری از تحقیقات جدید نانوذرات پاسخگو به چند محرک را طراحی کردهاند. این نانوذرات میتوانند هم به pH و آنزیمها پاسخ دهند و هم با نور یا حرارت خارجی فعال شوند.
-
مزیت: افزایش دقت آزادسازی دارو و کاهش احتمال آزادسازی ناخواسته در بافت سالم.
-
مثال: نانوذرات هیبریدی لیپید-پلیمری حساس به pH و حرارت که داروی ضدسرطان را در تومور آزاد میکنند و امکان پایش تصویربرداری را فراهم میآورند.
مزایای نانوپزشکی پاسخگو به محرکها
-
افزایش هدفمندی درمان : دارو فقط در محیط هدف آزاد میشود.
-
کاهش عوارض جانبی : بافت سالم تحت تأثیر دارو قرار نمیگیرد.
-
کنترل دقیق زمان و مکان آزادسازی دارو: پزشک میتواند فعالسازی را در زمان دلخواه انجام دهد.
-
امکان ترکیب با روشهای تصویربرداری و ترانستیک : امکان پایش زنده پاسخ تومور و بهبود تصمیمگیری بالینی.
-
توانایی مقابله با مقاومت دارویی : آزادسازی هدفمند دارو در محیطهای خاص سلولهای مقاوم به درمان.
مثالهای تحقیقاتی و بالینی
-
سرطان پستان : نانوذرات PLGA حساس به pH که دوکسوروبیسین را فقط در محیط تومور آزاد میکنند و کاهش اثرات جانبی سیستمیک را نشان دادهاند.
-
سرطان ریه : نانوذرات مغناطیسی پاسخگو به میدان خارجی که دارو را در محل تومور متمرکز کرده و تصویربرداری MRI را همزمان انجام میدهند.
-
سرطان کبد: نانوذرات حرارتی حساس به دما که با ترکیب با فتوترمال تراپی، تخریب موضعی سلولهای سرطانی را بهبود میبخشند.
-
سلولهای بنیادی سرطانی : نانوذرات پاسخگو به ROS که دارو را در سلولهای مقاوم به درمان آزاد میکنند و از عود مجدد تومور جلوگیری میکنند.
چالشها و محدودیتها
-
پیچیدگی طراحی و سنتز : طراحی نانوذرات چندمحرکه نیازمند فناوری پیشرفته است.
-
ایمنی طولانیمدت : برخی نانوذرات ممکن است تجمع طولانی در ارگانها ایجاد کنند.
-
هزینه تولید بالا : تولید نانوذرات پاسخگو به محرکها پیچیده و هزینهبر است.
-
تحقیقات بالینی محدود : بسیاری از سیستمها هنوز در مرحله تحقیقات قبل از بالینی یا آزمایشات اولیه انسانی هستند.
نانوپزشکی پاسخگو به محرکها، با استفاده از محرکهای داخلی و خارجی، امکان آزادسازی دقیق و کنترلشده دارو را فراهم میکند. این فناوری باعث افزایش هدفمندی درمان، کاهش اثرات جانبی و امکان ترکیب با تصویربرداری و ترانستیک میشود. نمونههای تحقیقاتی و بالینی نشان دادهاند که این سیستمها در سرطانهای پستان، ریه، کبد و سلولهای بنیادی سرطانی، اثر درمانی قابل توجهی دارند و مسیر توسعه درمانهای شخصیسازیشده را هموار کردهاند.
نانوپزشکی و درمان سرطانهای خاص
نانوپزشکی، با ارائه راهکارهای هدفمند، چندکاره و پاسخگو به محرکها، درمان سرطانها را متحول کرده است. هر نوع سرطان ویژگیهای بیولوژیکی، متابولیکی و رگی متفاوتی دارد و استفاده از نانوپزشکی میتواند درمانی شخصیسازیشده و اثربخشتر ارائه دهد. در ادامه، کاربرد نانوپزشکی در مهمترین سرطانهای شایع و چالشهای مربوطه بررسی شده است.
سرطان پستان
سرطان پستان یکی از شایعترین سرطانها در زنان است و درمان شیمیدرمانی سنتی با عوارض جانبی زیاد و مقاومت دارویی همراه است. نانوپزشکی با ارائه سیستمهای هدفمند، ترانستیک و پاسخگو به محرکها، این محدودیتها را کاهش داده است.
نانوذرات هدفمند در سرطان پستان
-
استفاده از نانوذرات PEGylated حاوی دوکسوروبیسین و متصل به آنتیبادی HER2 باعث ورود دقیق دارو به سلولهای HER2 مثبت شده و تجمع دارو در بافت سالم را کاهش میدهد.
-
پپتیدهای هدفمند RGD نیز برای اتصال به integrins overexpressed در سلولهای تومور پستان استفاده میشوند.
نانوپزشکی ترانستیک در سرطان پستان
-
لیپوزومهای ترانستیک با دارو و نانوذرات مغناطیسی امکان تصویربرداری MRI و پایش زنده درمان را فراهم میکنند.
-
سیستمهای چندکاره میتوانند هم دارو و فتوترمال تراپی ارائه دهند و هم فلورسانس برای تصویربرداری زنده داشته باشند.
نتایج بالینی
-
کاهش اثرات جانبی قلبی و سیستمیک
-
افزایش تجمع دارو در محل تومور
-
بهبود پاسخ درمانی در بیماران مقاوم به شیمیدرمانی
سرطان ریه
سرطان ریه، به ویژه نوع غیرسلولی کوچک (NSCLC)، چالشهای درمانی زیادی دارد، زیرا بافت ریه حساس و به آسانی آسیبپذیر است.
نانوذرات هدفمند و پاسخگو در سرطان ریه
-
نانوذرات مغناطیسی و پاسخگو به میدان خارجی میتوانند دارو را به تومور هدایت کنند.
-
سیستمهای پاسخگو به pH و ROS باعث آزادسازی دارو فقط در محیط تومور و کاهش اثرات جانبی بر بافت سالم ریه میشوند.
نانوپزشکی ترانستیک در سرطان ریه
-
نانوذرات چندکاره که دارو و فتوترمال یا عامل تصویربرداری MRI/PET را حمل میکنند، امکان تشخیص، درمان و پایش همزمان را فراهم میکنند.
-
این سیستمها میتوانند با ایمونوتراپی ترکیب شوند و پاسخ ایمنی به سلولهای سرطانی را افزایش دهند.
نتایج تحقیقاتی
-
تجمع دارو در محل تومور افزایش یافته است
-
کاهش سمیت سیستمیک و آسیب به بافت سالم
-
امکان درمان ترکیبی با فتوترمال و شیمیدرمانی
سرطان کبد (Hepatocellular carcinoma)
سرطان کبد یکی از سرطانهای کشنده با پاسخ محدود به درمانهای سنتی است. استفاده از نانوپزشکی امکان هدفگیری دقیق سلولهای سرطانی و کاهش عوارض جانبی بر کبد سالم را فراهم کرده است.
نانوذرات پاسخگو به محرکها
-
نانوذرات حرارتی حساس به دما که با فتوترمال تراپی ترکیب میشوند، دارو را در محیط تومور آزاد میکنند.
-
نانوذرات حساس به ROS و آنزیمهای کبدی باعث افزایش اثر درمانی و کاهش سمیت سیستمیک میشوند.
ترانستیک در سرطان کبد
-
نانوذرات فلزی و پلیمری با تصویربرداری MRI یا CT امکان پایش زنده و درمان همزمان را فراهم میکنند.
-
سیستمهای چندکاره میتوانند دارو، عامل تصویربرداری و پپتید هدفمند برای گیرندههای کبدی را حمل کنند.
مزایا و نتایج بالینی
-
افزایش دقت دارو و کاهش سمیت سیستمیک
-
امکان پایش پاسخ درمانی و اصلاح دوز دارو
-
بهبود اثربخشی درمان در تومورهای مقاوم
سرطان مغز (Glioblastoma) و سایر گلیوماها
سرطان مغز با سد خونی-مغزی (BBB) یک چالش بزرگ برای داروهای شیمیدرمانی ایجاد میکند. نانوپزشکی با طراحی سیستمهای هدفمند و پاسخگو، امکان عبور دارو از سد خونی-مغزی را فراهم کرده است.
نانوذرات مغناطیسی و پلیمری
-
نانوذرات مغناطیسی میتوانند با میدان خارجی هدایت شوند و تجمع در تومور مغزی افزایش یابد.
-
نانوذرات پلیمر حساس به pH یا ROS دارو را فقط در محیط تومور آزاد میکنند.
ترانستیک و تصویربرداری همزمان
-
نانوذرات ترانستیک با قابلیت MRI و PET امکان پایش دقیق دارو و تصویربرداری زنده تومور مغزی را فراهم میکنند.
-
ترکیب با فتوترمال تراپی یا داروهای ایمونومدولاتور امکان افزایش اثر درمانی و کاهش مقاومت دارویی را دارد.
نتایج تحقیقاتی و مزایا
-
بهبود ورود دارو به تومور مغزی
-
کاهش آسیب به بافت سالم مغز
-
امکان پایش زنده پاسخ درمانی و اصلاح سریع استراتژی درمان
سلولهای بنیادی سرطانی و تومورهای مقاوم
سلولهای بنیادی سرطانی (Cancer Stem Cells) مسئول عود تومور و مقاومت به دارو هستند. نانوپزشکی پاسخگو و هدفمند امکان حمل داروهای اختصاصی به این سلولها و کاهش احتمال عود تومور را فراهم میکند.
نانوذرات پاسخگو به ROS و pH
-
آزادسازی دارو فقط در سلولهای بنیادی سرطانی که سطح ROS بالاتری دارند.
-
کاهش اثرات جانبی بر سلولهای سالم و بافت اطراف تومور.
ترانستیک و ترکیبی با ایمونوتراپی
-
نانوذرات حاوی دارو و عامل تصویربرداری برای پایش سلولهای بنیادی سرطانی
-
امکان افزایش پاسخ ایمنی بدن و تخریب سلولهای مقاوم
نتایج بالینی و تحقیقاتی
-
کاهش عود تومور
-
افزایش اثربخشی درمان ترکیبی
-
کاهش سمیت سیستمیک و عوارض جانبی
چالشها و محدودیتها در سرطانهای خاص
-
تفاوت ساختاری و متابولیکی انواع سرطانها باعث میشود که طراحی نانوذرات نیازمند شخصیسازی باشد.
-
عبور از سد خونی-مغزی، تجمع در بافت کبد یا ریه و مقاومت دارویی، هنوز چالشهای مهمی هستند.
-
هزینه تولید و پیچیدگی سیستمهای چندکاره برای کاربرد بالینی محدودیت ایجاد میکند.
-
نیاز به تحقیقات بالینی گسترده برای تایید اثربخشی و ایمنی طولانیمدت.
نانوپزشکی با ارائه سیستمهای هدفمند، ترانستیک و پاسخگو به محرکها، درمان سرطانهای خاص را متحول کرده است. در سرطان پستان، ریه، کبد، مغز و سلولهای بنیادی سرطانی، این سیستمها باعث افزایش اثر دارویی، کاهش عوارض جانبی، امکان تصویربرداری و پایش زنده و مقابله با مقاومت دارویی شدهاند. نمونههای تحقیقاتی و بالینی نشان میدهند که نانوپزشکی مسیر درمان شخصیسازیشده و هدفمند را برای سرطانهای پیچیده هموار میکند.
ترکیب نانوپزشکی با سایر درمانها
یکی از مزایای اصلی نانوپزشکی، امکان ترکیب آن با سایر روشهای درمانی سرطان است. این ترکیبها نه تنها اثر درمانی را افزایش میدهند، بلکه امکان کاهش عوارض جانبی و مقابله با مقاومت دارویی را فراهم میکنند. در ادامه، مهمترین ترکیبهای نانوپزشکی با روشهای درمانی بررسی شدهاند.
نانوپزشکی و شیمیدرمانی
شیمیدرمانی سنتی محدودیتهایی دارد، از جمله سمیت سیستمیک بالا، مقاومت دارویی و عدم هدفگیری دقیق تومور. نانوپزشکی میتواند این محدودیتها را کاهش دهد.
سیستمهای نانوذرهای شیمیدرمانی
-
نانوذرات لیپیدی، پلیمری و فلزی میتوانند داروهای شیمیدرمانی را به صورت هدفمند حمل کرده و آزادسازی آنها را کنترل کنند.
-
نانوذرات پاسخگو به محرکهای داخلی مانند pH پایین یا ROS بالا، دارو را تنها در محیط تومور آزاد میکنند.
مزایا
-
افزایش تجمع دارو در تومور و کاهش سمیت سیستمیک
-
امکان ترکیب چند دارو در یک نانوذره برای درمان ترکیبی
-
کاهش مقاومت دارویی با آزادسازی هدفمند دارو
مثالهای بالینی
-
لیپوزومهای PEGylated حاوی دوکسوروبیسین که در سرطان پستان و ریه استفاده میشوند، تجمع دارو در تومور را افزایش داده و عوارض جانبی سیستمیک را کاهش دادهاند.
-
نانوذرات پلیمری چندکاره حاوی Paclitaxel و داروهای هدفمند ROS در درمان سرطانهای مقاوم به شیمیدرمانی موثر بودهاند.
نانوپزشکی و پرتودرمانی
پرتودرمانی یکی از روشهای اصلی درمان سرطان است، اما محدودیتهایی شامل آسیب به بافت سالم و عدم تمرکز دقیق بر تومور دارد. نانوپزشکی میتواند با افزایش حساسیت تومور به اشعه و کاهش آسیب به بافت سالم، اثربخشی پرتودرمانی را افزایش دهد.
نانوذرات حساس به اشعه (Radiosensitizers)
-
نانوذرات طلا، نقره و اکسید فلزی میتوانند اشعه را جذب کرده و اثر تخریبی آن را بر سلولهای سرطانی افزایش دهند.
-
نانوذرات چندکاره میتوانند هم دارو حمل کنند و هم حساسیت تومور به پرتودرمانی را افزایش دهند.
مزایا
-
افزایش اثر پرتودرمانی در محل هدف
-
کاهش دوز مورد نیاز و کاهش آسیب به بافت سالم
-
امکان ترکیب با درمانهای شیمیدرمانی و فتوترمال
مثالهای بالینی و تحقیقاتی
-
نانوذرات طلا همراه با پرتودرمانی در سرطان مغز و پستان، اثر درمانی را به شکل قابل توجهی افزایش دادهاند.
-
نانوذرات چندکاره که دارو و عامل تصویربرداری MRI را حمل میکنند، امکان پایش زنده پاسخ تومور به پرتودرمانی را فراهم میکنند.
نانوپزشکی و فتوترمال تراپی
فتوترمال تراپی (PTT) یک روش درمانی نوین است که با تبدیل نور به حرارت، سلولهای سرطانی را تخریب میکند. نانوپزشکی با ارائه نانوذرات فتوترمال هدفمند، اثر PTT را افزایش میدهد و امکان ترکیب با درمان دارویی و تصویربرداری همزمان را فراهم میکند.
نانوذرات فتوترمال
-
نانوذرات طلا و پلیمرهای هیبریدی که با نور مادون قرمز نزدیک (NIR) فعال میشوند.
-
امکان آزادسازی دارو و تخریب هدفمند سلولها در یک مرحله.
مزایا
-
تخریب دقیق سلولهای سرطانی بدون آسیب به بافت سالم
-
ترکیب درمان دارویی و فتوترمال برای افزایش اثربخشی
-
امکان پایش تصویربرداری همزمان و بهبود تصمیمگیری بالینی
مثالهای بالینی
-
نانوذرات فتوترمال طلا حاوی Paclitaxel در سرطان پستان و مغز، اثر درمانی ترکیبی را بهبود بخشیدهاند.
-
نانوذرات چندکاره پاسخگو به pH و حرارت امکان آزادسازی دقیق دارو و پایش تصویربرداری را فراهم کردهاند.
نانوپزشکی و ایمونوتراپی
ایمونوتراپی با هدف فعالسازی سیستم ایمنی بدن برای شناسایی و تخریب سلولهای سرطانی، تحول بزرگی در درمان سرطان ایجاد کرده است. ترکیب نانوپزشکی و ایمونوتراپی مزایای فراوانی دارد:
نانوذرات ایمونومدولاتور
-
نانوذرات میتوانند داروهای ایمونومدولاتور، آنتیبادیهای مونوکلونال و سیتوکینها را به تومور منتقل کنند.
-
برخی نانوذرات قادرند پاسخ ایمنی موضعی را تقویت و اثر سرکوب سیستمیک را کاهش دهند.
ترانستیک و پایش پاسخ ایمونوتراپی
-
نانوذرات ترانستیک حاوی عوامل تصویربرداری و ایمونومدولاتور امکان پایش زنده تجمع دارو و پاسخ ایمنی تومور را فراهم میکنند.
-
ترکیب با نانوذرات پاسخگو به محرکها، دارو را تنها در محیط تومور آزاد میکند.
مزایا
-
افزایش اثر درمان ایمونوتراپی
-
کاهش سمیت سیستمیک و اثرات جانبی غیرهدفمند
-
امکان ترکیب با شیمیدرمانی، فتوترمال یا پرتودرمانی برای اثر ترکیبی
مثالهای تحقیقاتی و بالینی
-
نانوذرات پلیمر-فلز حاوی سیتوکینها و داروهای شیمیدرمانی در سرطان پستان و ریه، پاسخ ایمنی موضعی را افزایش دادهاند.
-
نانوذرات چندکاره پاسخگو به ROS امکان آزادسازی دارو و ایمونومدولاتور تنها در سلولهای سرطانی مقاوم را فراهم کردهاند.
مزایای ترکیبی نانوپزشکی با سایر درمانها
-
افزایش اثر درمانی: ترکیب درمانها با نانوذرات باعث تقویت اثر هر روش و کاهش مقاومت دارویی میشود.
-
کاهش عوارض جانبی: هدفگیری دقیق و پاسخگو به محرکها، دارو و انرژی درمانی را تنها در محل تومور فعال میکند.
-
پایش زنده و ترانستیک : امکان تصویربرداری و بررسی پاسخ تومور به درمان در زمان واقعی.
-
شخصیسازی درمان : بر اساس ویژگیهای بیمار و تومور، ترکیب درمانها میتواند بهینه شود.
چالشها و محدودیتها
-
پیچیدگی طراحی نانوذرات چندکاره: ترکیب دارو، عامل تصویربرداری و پاسخگو به محرکها نیازمند فناوری پیشرفته است.
-
هزینه بالا: تولید و آزمایش سیستمهای ترکیبی گران و زمانبر است.
-
ایمنی طولانیمدت : نیاز به بررسی تجمع طولانیمدت نانوذرات در ارگانها و اثرات جانبی احتمالی.
-
محدودیتهای بالینی: بسیاری از سیستمها هنوز در مرحله تحقیقات بالینی اولیه هستند و نیاز به مطالعات گستردهتر دارند.
نانوپزشکی، با توانایی هدفگیری دقیق، پاسخگو بودن به محرکها و حمل چند دارو یا عامل تصویربرداری، امکان ترکیب موثر با شیمیدرمانی، پرتودرمانی، فتوترمال تراپی و ایمونوتراپی را فراهم میکند. این ترکیبها باعث افزایش اثر درمانی، کاهش عوارض جانبی، مقابله با مقاومت دارویی و امکان پایش زنده پاسخ تومور میشوند. نمونههای بالینی و تحقیقاتی نشان میدهند که نانوپزشکی، مسیر درمانهای ترکیبی و شخصیسازیشده سرطان را هموار کرده است.
چالشها و محدودیتهای بالینی نانوپزشکی
با وجود پیشرفتهای چشمگیر در نانوپزشکی و کاربرد آن در درمان سرطان، موانع متعددی برای انتقال موفق این فناوریها از آزمایشگاه به بالین وجود دارد. این چالشها شامل مسائل مربوط به ایمنی، تولید، مقررات و محدودیتهای بالینی است. در ادامه، مهمترین این چالشها به تفکیک توضیح داده شدهاند.
ایمنی و سمیت نانوذرات
یکی از بزرگترین چالشها، اثرات ایمنی و سمیت نانوذرات بر بدن انسان است. اگرچه نانوپزشکی امکان هدفگیری دقیق دارو را فراهم میکند، اما ویژگیهای فیزیکی و شیمیایی نانوذرات ممکن است منجر به واکنشهای غیرمنتظره شود.
تجمع طولانیمدت در ارگانها
-
برخی نانوذرات فلزی و پلیمرهای پایدار میتوانند در کبد، طحال و کلیه تجمع کنند.
-
این تجمع ممکن است باعث التهاب، آسیب سلولی و اختلال عملکرد ارگانها شود.
پاسخ ایمنی غیرهدفمند
-
نانوذرات ممکن است سیستم ایمنی را تحریک کنند و باعث واکنشهای آلرژیک یا تولید سایتوکینهای التهابی شوند.
-
طراحی نانوذرات با پوشش PEG یا استفاده از پلیمرهای زیستسازگار میتواند این اثرات را کاهش دهد، اما هنوز کاملاً حل نشده است.
سمیت طولانیمدت ناشناخته
-
بسیاری از نانوذرات جدید هنوز مطالعات طولانیمدت بالینی و پس از انتشار در انسان را تجربه نکردهاند.
-
خطرات احتمالی، مانند سرطانزایی یا آسیب ژنتیکی، هنوز به طور کامل مشخص نیست.
تولید و مقیاسپذیری
توسعه نانوپزشکی در مقیاس بالینی با چالشهای فنی و اقتصادی مواجه است.
پیچیدگی طراحی نانوذرات چندکاره
-
نانوذرات چندکاره که هم دارو حمل کنند، هم پاسخگو به محرکها باشند و هم تصویربرداری را ممکن سازند، طراحی و سنتز پیچیدهای دارند.
-
هر تغییر کوچک در اندازه، شکل یا پوشش سطحی نانوذرات میتواند اثر درمانی را تغییر دهد.
مقیاسپذیری تولید
-
سنتز نانوذرات در مقیاس آزمایشگاهی آسان است، اما تولید صنعتی با کیفیت ثابت، یکنواختی اندازه و ویژگیهای سطحی کنترلشده چالش بزرگی است.
-
عدم کنترل دقیق میتواند منجر به اثرات جانبی ناخواسته یا کاهش اثربخشی درمان شود.
هزینه تولید بالا
-
فناوریهای نانوپزشکی، به ویژه نانوذرات چندکاره و پاسخگو به محرکها، گران و زمانبر هستند.
-
این هزینهها میتوانند دسترسی بیماران به درمان را محدود کنند.
محدودیتهای بالینی و انتقال از آزمایشگاه به بیمار
تفاوتهای بین مدلهای حیوانی و انسان
-
بسیاری از نانوذرات پیشرفته در مدلهای حیوانی موفق عمل کردهاند، اما پاسخهای ایمنی و متابولیسم در انسان متفاوت است.
-
این تفاوتها باعث میشوند که اثربخشی آزمایشگاهی به طور کامل در بیمار دیده نشود.
کنترل آزادسازی دارو در شرایط بالینی واقعی
-
در آزمایشگاه، کنترل دقیق pH، ROS و میدان مغناطیسی امکانپذیر است، اما در بدن انسان محیط بیولوژیکی پیچیده و متغیر است.
-
این پیچیدگی میتواند منجر به آزادسازی ناخواسته دارو و افزایش سمیت سیستمیک شود.
پایداری و دفع نانوذرات
-
برخی نانوذرات پس از آزادسازی دارو، در بدن باقی میمانند و دفع آنها به سختی و با تاخیر صورت میگیرد.
-
نیاز به طراحی نانوذرات قابل تجزیه و زیستسازگار احساس میشود.
محدودیتهای مقرراتی و استانداردسازی
توسعه نانوپزشکی در بالین نیازمند رعایت مقررات سختگیرانه و اثبات ایمنی و اثربخشی است.
استانداردسازی کیفیت و ویژگیها
-
نانوذرات باید از نظر اندازه، شکل، بار سطحی و پوشش به طور دقیق کنترل شوند.
-
عدم یکنواختی میتواند منجر به اثرات متفاوت و پیشبینیناپذیر در بیماران شود.
تایید بالینی و مقررات ملی و بینالمللی
-
سازمانهای دارویی مانند FDA و EMA، نیازمند مطالعات بالینی گسترده و طولانیمدت هستند.
-
فرآیند تایید نانوپزشکی پیچیدهتر و زمانبر از داروهای سنتی است، زیرا شامل بررسی اثرات فیزیکوشیمیایی و ایمنی نانوذرات نیز میشود.
محدودیتهای بازار و پذیرش بالینی
-
حتی پس از تایید، هزینه بالا و پیچیدگی تولید میتواند مانع ورود گسترده نانوپزشکی به بازار شود.
-
آموزش و پذیرش پزشکان و بیماران نیز عامل مهمی در موفقیت بالینی است.
چالشهای ترکیبی
-
ترکیب نانوپزشکی با سایر درمانها مانند شیمیدرمانی، پرتودرمانی و ایمونوتراپی، پیچیدگیهای جدیدی ایجاد میکند.
-
نیاز به هماهنگی دوزها، زمانبندی درمانها و بررسی تعاملات دارویی است.
-
احتمال ایجاد اثرات جانبی غیرمنتظره یا افزایش سمیت ترکیبی وجود دارد.
راهکارها و رویکردهای پیشنهادی
برای مقابله با چالشها، رویکردهای زیر پیشنهاد شدهاند:
-
طراحی نانوذرات زیستسازگار و قابل تجزیه : کاهش تجمع طولانی و سمیت طولانیمدت.
-
مطالعات طولانیمدت و چندمرحلهای بالینی : شناسایی اثرات جانبی دیررس و پاسخ بیمار.
-
کنترل دقیق فرایند تولید و استانداردسازی ویژگیها : تضمین یکنواختی و اثربخشی نانوذرات.
-
آموزش و اطلاعرسانی به پزشکان و بیماران : افزایش پذیرش و استفاده بالینی.
-
توسعه نانوذرات پاسخگو به محرکها با قابلیت تنظیم و کنترل آزادسازی : کاهش ریسک آزادسازی ناخواسته دارو.
با وجود پیشرفتهای علمی، چالشها و محدودیتهای بالینی نانوپزشکی هنوز مانع توسعه گسترده آن در درمان سرطان هستند. مسائل مربوط به ایمنی، سمیت طولانیمدت، پیچیدگی تولید، مقیاسپذیری و مقررات از جمله موانع اصلی هستند. با این حال، طراحی نانوذرات زیستسازگار، مطالعات بالینی طولانیمدت و استانداردسازی فرایندها میتوانند این چالشها را کاهش داده و مسیر ورود نانوپزشکی به بالین را هموار کنند.
آینده نانوپزشکی در درمان سرطان
با وجود پیشرفتهای قابل توجه در نانوپزشکی، مسیر توسعه و بهکارگیری آن در درمان سرطان همچنان پر از نوآوری، چالش و فرصتهای بالقوه است. چشمانداز آینده شامل بهبود طراحی نانوذرات، ترکیب درمانهای چندگانه، تصویربرداری پیشرفته و شخصیسازی درمانهاست.
نوآوریهای پیشرو در طراحی نانوذرات
یکی از محورهای اصلی آینده نانوپزشکی، طراحی نانوذرات هوشمند، چندکاره و پاسخگو به محرکها است. این نوآوریها شامل موارد زیر هستند:
نانوذرات چندکاره و ترکیبی
-
نانوذراتی که قادر به حمل چند دارو، عوامل تصویربرداری و ایمونومدولاتور هستند، امکان درمان ترکیبی و پایش زنده تومور را فراهم میکنند.
-
این سیستمها میتوانند در زمان واقعی پاسخ تومور را ارزیابی و دوز دارو را بهینه کنند.
نانوذرات پاسخگو به محرکهای زیستی و خارجی
-
نانوذرات حساس به pH، ROS، دما، نور و میدان مغناطیسی میتوانند دارو را تنها در محیط تومور آزاد کنند.
-
این ویژگیها باعث کاهش سمیت سیستمیک و افزایش اثر درمانی میشوند.
نانوذرات زیستسازگار و قابل تجزیه
-
توسعه نانوذرات زیستسازگار، که پس از انجام وظیفه درمانی در بدن تجزیه میشوند، یکی از اهداف اصلی تحقیقاتی است.
-
این رویکرد میتواند خطرات تجمع طولانیمدت و سمیت مزمن را کاهش دهد.
شخصیسازی درمان سرطان با نانوپزشکی
آینده نانوپزشکی به سمت درمانهای شخصیسازیشده حرکت میکند، که بر اساس ویژگیهای ژنتیکی، مولکولی و بیولوژیکی هر بیمار طراحی میشوند.
نانوذرات مبتنی بر بیومارکرها
-
طراحی نانوذراتی که به بیومارکرهای خاص تومور متصل میشوند، امکان هدفگیری دقیق سلولهای سرطانی و کاهش اثر بر بافت سالم را فراهم میکند.
پایش زنده و تصمیمگیری درمانی
-
سیستمهای ترانستیک با قابلیت تصویربرداری MRI، PET یا فلورسانس امکان پایش زنده تجمع دارو و پاسخ تومور را فراهم میکنند.
-
این امکان به پزشکان کمک میکند تا در زمان واقعی دوز و ترکیب درمان را تنظیم کنند.
ترکیب درمانهای چندگانه
-
ترکیب شیمیدرمانی، ایمونوتراپی، فتوترمال تراپی و پرتودرمانی در یک نانوذره چندکاره، امکان افزایش اثر درمانی و کاهش مقاومت دارویی را فراهم میکند.
ادغام نانوپزشکی و ایمونوتراپی
یکی از مسیرهای آینده پرامید، ترکیب نانوپزشکی با ایمونوتراپی است.
نانوذرات ایمونومدولاتور پیشرفته
-
این نانوذرات میتوانند داروهای ایمونومدولاتور، آنتیبادیهای مونوکلونال و سیتوکینها را هدفمند به تومور منتقل کنند.
-
همچنین میتوانند محیط تومور را به گونهای تغییر دهند که پاسخ ایمنی بدن به سلولهای سرطانی افزایش یابد.
ایمونوتراپی ترکیبی با شیمیدرمانی و فتوترمال
-
نانوذرات چندکاره میتوانند هم داروهای شیمیدرمانی، هم عامل فتوترمال و هم ایمونومدولاتور را همزمان حمل کنند.
-
این ترکیبها باعث افزایش اثر درمانی، کاهش مقاومت دارویی و بهبود پاسخ ایمنی میشوند.
پایش پاسخ ایمنی
-
استفاده از نانوذرات ترانستیک با قابلیت تصویربرداری امکان پیگیری پاسخ ایمنی در زمان واقعی را فراهم میکند و طراحی درمانهای دقیقتر را ممکن میسازد.
فناوریهای تصویربرداری پیشرفته و درمانی همزمان
یکی از ویژگیهای آینده نانوپزشکی، ترانستیک و تصویربرداری پیشرفته همزمان با درمان است.
نانوذرات تصویربرداری چندحسی (Multimodal Imaging)
-
امکان ترکیب MRI، PET، CT و فلورسانس در یک نانوذره برای تصویربرداری دقیق و پایش پاسخ درمان.
-
این فناوری باعث میشود پزشکان بتوانند اثربخشی درمان را پیشبینی و اصلاح کنند.
پایش زنده و درمان تطبیقی
-
نانوذرات پاسخگو به محرکهای داخلی و خارجی میتوانند دارو را تنها در زمان مناسب و محل مناسب آزاد کنند.
-
این قابلیت امکان درمان تطبیقی و کاهش عوارض جانبی سیستمیک را فراهم میکند.
چشمانداز تحقیقاتی و توسعه بالینی
آینده نانوپزشکی نیازمند مطالعات بالینی گسترده و چندمرحلهای است تا مزایا و محدودیتهای این فناوری روشن شود.
پیشرفت در مدلهای پیشبینی بالینی
-
توسعه مدلهای پیشبینی دقیق انسان با استفاده از ارگانوئیدها، مدلهای حیوانی پیشرفته و شبیهسازی کامپیوتری.
-
این مدلها امکان بهینهسازی نانوذرات و دوز درمانی قبل از ورود به بالین را فراهم میکنند.
مطالعات بلندمدت ایمنی و سمیت
-
نیاز به بررسی اثرات طولانیمدت نانوذرات در ارگانها و سیستم ایمنی.
-
شناسایی خطرات احتمالی مانند تجمع طولانی، سرطانزایی یا اثرات ژنتیکی.
همکاری بینرشتهای و صنعتی
-
ترکیب دانش شیمی، زیستشناسی، مهندسی نانو و پزشکی برای توسعه نانوذرات پیشرفته.
-
همکاری با صنعت برای تولید مقیاسپذیر، استانداردسازی و مقرراتی سازی.
چشمانداز نوآوریهای آینده
-
نانوذرات هوشمند خودران : سیستمهایی که خود را به تومور هدایت کرده و به طور خودکار دارو را آزاد میکنند.
-
بیوسنسورهای درونتنی: نانوذراتی که تغییرات مولکولی تومور را پایش کرده و پاسخ درمانی را به صورت بیولوژیکی تنظیم میکنند.
-
درمانهای ترکیبی چندمرحلهای : نانوذراتی که مرحله به مرحله دارو، فتوترمال و ایمونومدولاتور را آزاد میکنند.
-
یادگیری ماشینی و هوش مصنوعی در طراحی نانوذرات : پیشبینی رفتار نانوذرات در بدن و بهینهسازی طراحی آنها.
آینده نانوپزشکی در درمان سرطان، پر از نوآوری و فرصتهای تحولآفرین است. طراحی نانوذرات هوشمند، شخصیسازی درمان، ترکیب با ایمونوتراپی و دیگر درمانها، و تصویربرداری پیشرفته، مسیر توسعه درمانهای موثر، کمعارضه و تطبیقی را هموار میکند. با ادامه تحقیقات، استانداردسازی تولید، مطالعات بالینی گسترده و همکاری بینرشتهای، نانوپزشکی میتواند نقش کلیدی در بهبود کیفیت زندگی بیماران و افزایش بقای آنها ایفا کند.
سوالات متداول (FAQ) در زمینه نانوپزشکی برای درمان سرطان
در ادامه، پرتکرارترین پرسشهایی که متخصصان و بیماران درباره نانوپزشکی و درمان سرطان دارند، همراه با پاسخهای علمی و کاربردی ارائه شده است. این بخش به شما کمک میکند تا درک جامعی از مزایا، محدودیتها و کاربردهای نانوپزشکی داشته باشید.
نانوپزشکی چیست و چگونه در درمان سرطان کاربرد دارد؟
-
نانوپزشکی شاخهای از پزشکی است که از نانوذرات و نانوساختارها برای تشخیص، درمان و پایش بیماریها استفاده میکند.
-
در درمان سرطان، نانوذرات میتوانند داروهای شیمیدرمانی، عوامل ایمونومدولاتور و عوامل تصویربرداری را به طور هدفمند به سلولهای سرطانی منتقل کنند.
-
این روش باعث افزایش اثر درمانی و کاهش سمیت سیستمیک میشود.
مزایای نانوپزشکی نسبت به درمانهای سنتی چیست؟
-
هدفگیری دقیق : نانوذرات میتوانند دارو را مستقیماً به تومور برسانند.
-
کاهش عوارض جانبی : با کاهش تماس دارو با بافت سالم، سمیت سیستمیک کاهش مییابد.
-
ترکیب درمانها : امکان ترکیب شیمیدرمانی، ایمونوتراپی و فتوترمال تراپی در یک نانوذره.
-
پایش زنده : برخی نانوذرات ترانستیک امکان تصویربرداری و پایش پاسخ تومور در زمان واقعی را دارند.
چه انواع نانوذراتی در درمان سرطان استفاده میشوند؟
-
نانوذرات لیپیدی (Liposomes و Solid Lipid Nanoparticles): برای حمل داروهای محلول در چربی و کاهش سمیت.
-
نانوذرات پلیمری : قابل تنظیم و پاسخگو به محرکهای داخلی و خارجی.
-
نانوذرات فلزی : (Gold, Iron Oxide) برای درمان فتوترمال و تصویربرداری MRI.
-
نانوذرات هیبریدی و چندکاره : ترکیب دارو، عوامل تصویربرداری و ایمونومدولاتور.
نانوپزشکی چگونه سرطان را هدف قرار میدهد؟
-
هدفگیری غیرفعال : نانوذرات به دلیل اندازه و نفوذپذیری بالا در تومور تجمع مییابند (اثر EPR).
-
هدفگیری فعال : سطح نانوذرات با آنتیبادیها، پپتیدها یا لیگاندهای خاص تومور پوشیده میشود.
-
پاسخگو به محرکها : نانوذرات تنها در محیط تومور یا تحت محرک خارجی دارو را آزاد میکنند.
آیا نانوپزشکی در درمان سرطانهای خاص موثر است؟
-
مطالعات نشان دادهاند که نانوپزشکی در سرطانهای پستان، ریه، پروستات، کولورکتال و کبد کاربرد دارد.
-
نانوذرات میتوانند سلولهای بنیادی سرطانی مقاوم به درمان را نیز هدف قرار دهند.
-
برخی سیستمها قابلیت ترکیب با ایمونوتراپی و فتوترمال تراپی را دارند تا اثر درمانی را افزایش دهند.
آیا نانوپزشکی میتواند جایگزین شیمیدرمانی سنتی شود؟
-
نانوپزشکی مکمل شیمیدرمانی است و هدف آن افزایش اثربخشی و کاهش عوارض داروهای شیمیدرمانی است.
-
در آینده، با توسعه نانوذرات هوشمند و چندکاره، امکان کاهش دوز داروهای شیمیدرمانی سنتی و افزایش ایمنی بیماران فراهم میشود.
آیا نانوپزشکی عوارض جانبی دارد؟
-
نانوپزشکی نسبت به درمانهای سنتی، عوارض سیستمیک کمتری دارد، اما هنوز چالشهای ایمنی و سمیت طولانیمدت وجود دارد.
-
برخی نانوذرات فلزی و پایدار میتوانند در کبد، کلیه و طحال تجمع کنند و باعث التهاب یا آسیب سلولی شوند.
-
طراحی نانوذرات زیستسازگار و قابل تجزیه در حال کاهش این ریسکها است.
نانوپزشکی چگونه با ایمونوتراپی ترکیب میشود؟
-
نانوذرات میتوانند داروهای ایمونومدولاتور، آنتیبادیها یا سیتوکینها را به طور هدفمند به محیط تومور منتقل کنند.
-
این روش باعث تقویت پاسخ ایمنی بدن، کاهش مقاومت تومور و افزایش اثر درمانی میشود.
-
برخی نانوذرات حتی قابلیت پایش پاسخ ایمنی در زمان واقعی را دارند.
آیا نانوپزشکی میتواند تصویربرداری و درمان را همزمان انجام دهد؟
-
بله، سیستمهای ترانستیک و نانوذرات تصویربرداری چندحسی میتوانند دارو را آزاد کرده و همزمان MRI، PET، CT یا فلورسانس ایجاد کنند.
-
این فناوری امکان پایش زنده تومور، ارزیابی اثربخشی درمان و تنظیم دوز دارو را فراهم میکند.
چالشهای نانوپزشکی چیست؟
-
ایمنی و سمیت طولانیمدت : تجمع نانوذرات در ارگانها و اثرات ایمنی ناشناخته.
-
پیچیدگی تولید و مقیاسپذیری : تولید صنعتی نانوذرات چندکاره دشوار و گران است.
-
محدودیتهای بالینی و مقررات : نیاز به مطالعات بالینی گسترده و استانداردسازی.
-
پذیرش بالینی: آموزش پزشکان و بیماران برای استفاده ایمن و موثر از نانوپزشکی.
آینده نانوپزشکی چه خواهد بود؟
-
طراحی نانوذرات هوشمند، پاسخگو و چندکاره.
-
شخصیسازی درمانها بر اساس ویژگیهای ژنتیکی و مولکولی بیماران.
-
ادغام با ایمونوتراپی و درمانهای ترکیبی برای افزایش اثر درمانی و کاهش مقاومت دارویی.
-
استفاده از هوش مصنوعی و یادگیری ماشینی برای طراحی نانوذرات و پیشبینی رفتار آنها در بدن.
-
توسعه بیوسنسورها و نانوذرات خودران برای پایش زنده و آزادسازی دقیق دارو.
چقدر نانوپزشکی در دسترس بیماران است؟
-
برخی نانوذرات مانند لیپوزومهای دارویی و نانوذرات پلیمری استاندارد هماکنون در بالین استفاده میشوند.
-
نانوپزشکی پیشرفته، به ویژه نانوذرات چندکاره و پاسخگو به محرکها، هنوز در مرحله آزمایش بالینی یا پیشبالینی است.
-
با پیشرفت تحقیقات، انتظار میرود در سالهای آینده دسترسی گستردهتر و مقرونبهصرفهتر شود.
چگونه میتوان از ایمنی نانوپزشکی اطمینان حاصل کرد؟
-
استفاده از نانوذرات زیستسازگار و قابل تجزیه.
-
انجام مطالعات بالینی طولانیمدت و چندمرحلهای برای شناسایی اثرات جانبی دیررس.
-
کنترل دقیق اندازه، شکل، پوشش و بار سطحی نانوذرات در تولید صنعتی.
نانوپزشکی چه تاثیری بر کیفیت زندگی بیماران دارد؟
-
کاهش عوارض جانبی سیستمیک شیمیدرمانی باعث بهبود کیفیت زندگی و تحمل درمان میشود.
-
هدفگیری دقیق و ترکیب درمانها میتواند اثربخشی درمان را افزایش داده و نرخ بقا را بهبود بخشد.
-
امکان پایش زنده و تنظیم درمان به پزشکان کمک میکند تا تصمیمات درمانی بهتر و شخصیسازی شده اتخاذ کنند.
آیا نانوپزشکی میتواند سرطانهای مقاوم به درمان را کنترل کند؟
-
نانوذرات میتوانند سلولهای بنیادی سرطانی و سلولهای مقاوم به دارو را هدف قرار دهند.
-
ترکیب با ایمونوتراپی و فتوترمال تراپی میتواند اثربخشی درمان در تومورهای مقاوم را افزایش دهد.
چشمانداز علمی و پژوهشی آینده چیست؟
-
تحقیقات در حال طراحی نانوذرات خودران، هوشمند و قابل پایش زنده هستند.
-
توسعه مدلهای پیشبینی بالینی و استفاده از هوش مصنوعی برای پیشبینی رفتار نانوذرات.
-
تمرکز بر ترکیب درمانهای چندگانه و شخصیسازی درمانها برای بیماران مختلف.
بخش سوالات متداول، پاسخگوی پرسشهای اساسی درباره نانوپزشکی، مزایا، محدودیتها، ایمنی و آینده آن است. نانوپزشکی با هدف افزایش اثربخشی درمان، کاهش عوارض جانبی و شخصیسازی درمان سرطان وارد بالین شده و مسیر پیشرفت آن همچنان پر از نوآوری و فرصت است. مطالعات بالینی گسترده، طراحی هوشمند نانوذرات و استانداردسازی تولید از عوامل کلیدی موفقیت در آینده نانوپزشکی هستند.