کریسپر چیست
🔹 مقدمه: سیستم دفاعی میکروبها
کریسپر (CRISPR) در اصل یک سیستم ایمنی طبیعی در باکتریها و آرکیها (نوعی میکروارگانیسم اولیه) است که به آنها کمک میکند در برابر حملات ویروسها از خود دفاع کنند.
وقتی یک ویروس به باکتری حمله میکند، این سلول هوشمندانه بخشی از DNA ویروسی را درون ژنوم خود ادغام میکند. این کار باعث میشود که اگر همان ویروس در آینده دوباره وارد شود، باکتری بتواند بهصورت اختصاصی آن را شناسایی و نابود کند. این فرآیند تا حد زیادی مشابه سیستم ایمنی تطبیقی انسان است؛ همانطور که بدن ما پس از یک بار درگیری با ویروس (مثلاً سرماخوردگی یا کرونا)، در دفعات بعدی واکنش سریعتر و مؤثرتری نشان میدهد.
🔹 کریسپر یعنی چه؟
واژه "کریسپر" مخفف عبارت:
Clustered Regularly Interspaced Short Palindromic Repeats
به فارسی: تناوبهای کوتاه پالیندروم فاصلهدار منظم خوشهای
این توالیها به صورت طبیعی در ژنوم باکتریها و آرکیها وجود دارند و ساختاری خاص دارند: قطعاتی از DNA ویروسی که بین توالیهای تکراری پالیندروم قرار گرفتهاند.
توالیهای پالیندروم (Palindromic Sequences) بخشی از DNA هستند که اگر از جهت '5 به '3 خوانده شوند و سپس رشته مکمل نیز از همان جهت خوانده شود، هر دو دارای همان ترتیب بازهای نوکلئوتیدی خواهند بود. به همین دلیل به آنها "معکوسپذیر" گفته میشود. این ویژگی ساختاری، برای شناسایی دقیق توالیهای مهاجم بسیار کلیدی است.
🔹 سازوکار دفاعی کریسپر چگونه است؟
هنگامی که ویروس وارد سلول باکتریایی میشود، باکتری بخشی از DNA آن را برش میزند و در کنار سایر توالیهای مشابه ویروسی در ژنوم خود ذخیره میکند. این قسمتهای ویروسی ذخیرهشده، با فاصلههایی مشخص بین توالیهای پالیندروم قرار میگیرند.
در مرحله بعد، باکتری از روی این DNA ذخیرهشده رونویسی میکند و نوعی RNA میسازد به نام RNA راهنما یا Guide RNA (gRNA).
این RNA حاوی اطلاعات دقیق از توالی ویروسی قبلی است و میتواند هر ویروس مهاجم جدیدی که توالی مشابه دارد را شناسایی کند.
🔹 نقش آنزیم Cas9
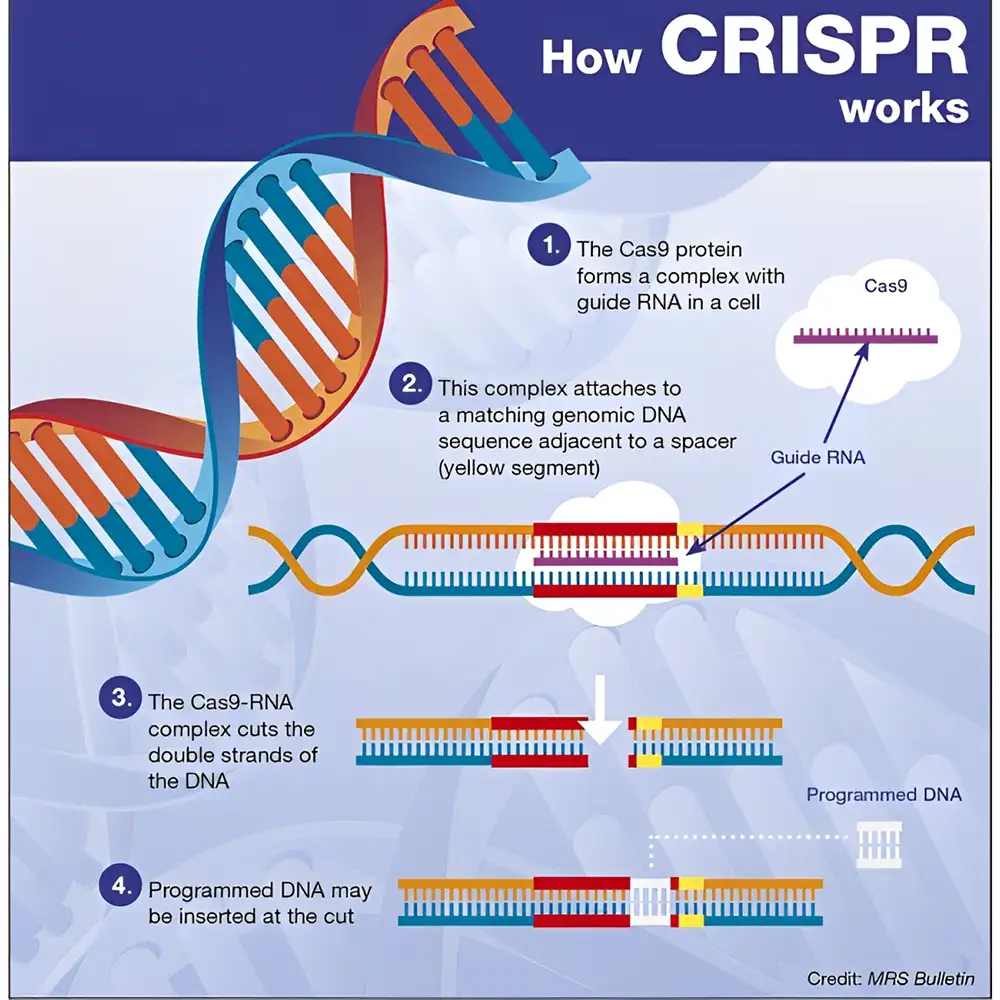
برای از بین بردن ویروس، RNA راهنما با یک آنزیم نوکلئاز به نام Cas9 وارد عمل میشود. RNA راهنما به توالی مشابه در DNA ویروس متصل میشود و Cas9 را هدایت میکند تا دقیقاً در همان نقطه برش دو رشتهای در DNA ایجاد کند. پس از این برش، DNA ویروسی از کار میافتد و دیگر نمیتواند باکتری را آلوده کند.
این همکاری بین RNA راهنما و Cas9 مانند یک سیستم هدفگیر و تیرانداز دقیق عمل میکند.
🔹 اجزای اصلی سیستم کریسپر
سیستم کریسپر-Cas9 برای عملکرد صحیح، به دو مؤلفهی اصلی نیاز دارد:
-
RNA راهنما (gRNA)
که مسئول شناسایی توالی هدف در ژنوم است. -
آنزیم Cas9
که نقش قیچی ژنتیکی را دارد و DNA را در محل مناسب قطع میکند.
🔹 مراحل ویرایش ژنوم با استفاده از کریسپر
فرآیند ویرایش ژن به کمک سیستم کریسپر-Cas9 در سه مرحلهی اصلی انجام میشود:
-
شناسایی (Targeting):
RNA راهنما توالی هدف را شناسایی و به آن متصل میشود. -
شکست (Cleavage):
آنزیم Cas9 برش دقیق در DNA هدف ایجاد میکند. -
ترمیم (Repair):
سلول پس از این برش، از یکی از مسیرهای ترمیم DNA برای بازسازی یا ویرایش ژن استفاده میکند.
🔹 چالشهای پیش روی استفاده از کریسپر در پزشکی
اگرچه سیستم کریسپر-Cas9 به عنوان ابزار قدرتمند ویرایش ژن در علوم پزشکی و درمان بیماریهای ژنتیکی مورد استفاده قرار میگیرد، اما چند مانع مهم برای استفاده گسترده از آن در بالین وجود دارد:
-
ایمنیزایی (Immunogenicity):
ممکن است بدن نسبت به اجزای سیستم واکنش ایمنی نشان دهد. -
نحوه انتقال به سلولها (Delivery System):
انتقال مؤثر gRNA و Cas9 به داخل سلولهای هدف هنوز چالشبرانگیز است. -
عوارض ناخواسته (Off-target Effects):
امکان دارد برشهای ناخواسته در ژنوم رخ دهد که باعث مشکلات ژنتیکی جدید شود. -
مسائل اخلاقی:
بهویژه در مورد ویرایش ژنوم انسان، نگرانیهای عمیق اخلاقی و حقوقی مطرح است.
🧬 کریسپر-Cas9 دقیقاً چیست و چگونه عمل میکند؟
در سیستم طبیعی کریسپر، باکتریها برای مقابله با ویروسها از آنزیمی به نام Cas استفاده میکنند. این آنزیم قادر است به DNA ویروسها متصل شود و برشهایی دقیق و هدفمند در آن ایجاد کند.
قطعهای از DNA ویروس که توسط آنزیم Cas بریده میشود، پروتوسپیسر (Protospacer) نام دارد. این قطعه به عنوان حافظه ایمنی در ژنوم باکتری ذخیره میشود.
بین این قطعات، توالیهای پالیندروم تکرارشونده قرار دارند که نظم و ساختار سیستم را حفظ میکنند. در صورت حمله مجدد ویروسی، RNAهای حاصل از این ناحیه به کمک Cas9، ویروس را هدف قرار داده و نابود میکنند.
🔹 RNA راهنما و PAM چیست؟
در این سیستم دو RNA مهم وجود دارد:
-
crRNA (CRISPR RNA):
مکمل توالی پروتوسپیسر و مسئول شناسایی توالی هدف. -
tracrRNA (Trans-activating crRNA):
نقش پشتیبان را ایفا میکند و باعث فعالسازی سیستم میشود.
ترکیب این دو RNA، یک RNA راهنما (gRNA) ایجاد میکند که با Cas9 کمپلکس تشکیل میدهد.
آنزیم Cas9 ابتدا توالی PAM (Protospacer Adjacent Motif) را روی DNA ویروس شناسایی میکند. این توالی، برای تشخیص صحیح نقطه هدف ضروری است. در صورت وجود PAM، Cas9 ناحیه بالادستی آن را بررسی کرده و اگر مکمل gRNA باشد، DNA را در همانجا برش میدهد.
ویروسها برخلاف سلولهای انسانی، قابلیت ترمیم DNA ندارند. بنابراین پس از برش، ویروس عملاً نابود میشود.
🧬 تغییرات مهندسی شده در کریسپر برای استفاده در زیستفناوری
دانشمندان با بررسی دقیق سیستم طبیعی کریسپر-Cas9، آن را بهینهسازی کردهاند تا برای ویرایش ژنوم هر موجود زندهای قابل استفاده باشد.
تغییر اصلی، ترکیب crRNA و tracrRNA در قالب یک RNA راهنمای تکرشتهای به نام sgRNA (Single Guide RNA) بود. این نوآوری، استفاده از سیستم را سادهتر، سریعتر و ارزانتر کرد.
در این روش، تنها کافی است یک sgRNA جدید طراحی شود تا Cas9 را به توالی خاصی در ژنوم هدایت کند. اما باید توجه داشت که توالی هدف حتماً باید حاوی PAM باشد؛ در غیر این صورت Cas9 نمیتواند وظیفهاش را انجام دهد.
🔹 مراحل عملی ویرایش ژن با کریسپر-Cas9
-
برش دو رشتهای در DNA هدف:
Cas9 به کمک gRNA، محل خاصی را شناسایی کرده و در آن نقطه شکست ایجاد میکند. -
ترمیم DNA با یکی از دو مسیر زیر:
-
NHEJ (Non-Homologous End Joining):
اتصال سریع و غیر دقیق انتهای بریدهشده؛ معمولاً برای غیرفعالسازی ژنها استفاده میشود. -
HDR (Homology-Directed Repair):
ترمیم دقیق بر اساس الگویی که از بیرون وارد شده؛ برای اضافه کردن ژن جدید یا ویرایش دقیق ژنتیکی کاربرد دارد.
-
🔬 روشها و تکنیکهای کریسپر (CRISPR) در ویرایش ژنوم
فناوری کریسپر (CRISPR) به عنوان یکی از قدرتمندترین ابزارهای ویرایش ژن، تحول شگرفی در زیستفناوری و زیستپزشکی ایجاد کرده است. این سیستم نه تنها امکان حذف یا اضافه کردن ژنها را فراهم میسازد، بلکه از آن برای تنظیم بیان ژنها، غربالگری ژنتیکی، و ویرایش دقیق تکنوکلئوتیدی نیز استفاده میشود.
در ادامه با مهمترین روشها و تکنیکهای مبتنی بر کریسپر آشنا خواهید شد:
✅ حذف ژن با استفاده از کریسپر (CRISPR Gene Knockout)
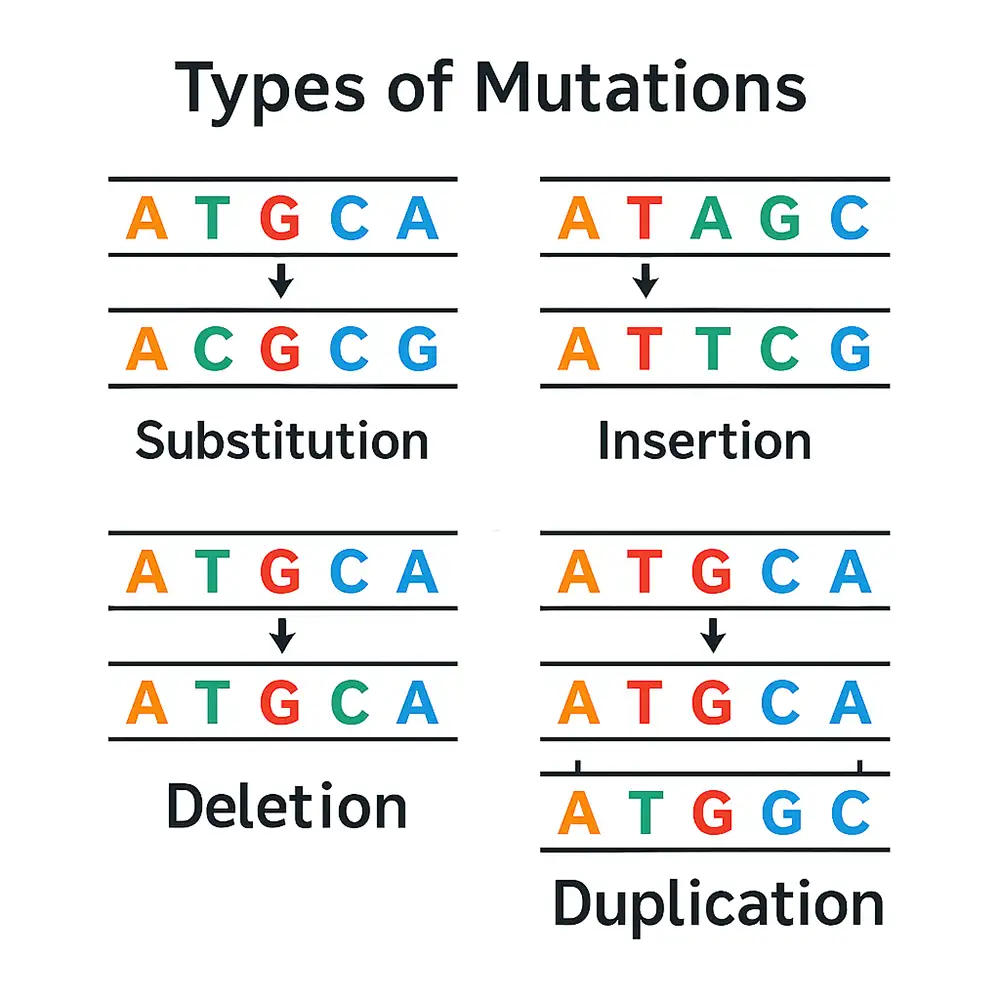
زمانی که آنزیم Cas9 هر دو رشته DNA را در ناحیهای خاص برش میدهد، سلول برای ترمیم این شکست معمولاً از مکانیسم پیوند انتهایی غیرهمولوگ (NHEJ) استفاده میکند. این روش ترمیم، گرچه سریع است، اما دقت پایینی دارد. در طی آن، معمولاً چند نوکلئوتید به DNA افزوده یا از آن حذف میشوند. این تغییرات با عنوان درج-حذف (Insertion-Deletion | Indel) شناخته میشوند.
اگر این تغییرات در ناحیه کدکننده ژن رخ دهند، احتمالاً باعث ایجاد جهش تغییر چارچوب (Frameshift Mutation) میشوند که نتیجه آن غیرفعال شدن ژن هدف خواهد بود. به این فرآیند در مجموع حذف ژن (Gene Knockout | KO) گفته میشود.
برای افزایش احتمال موفقیت در حذف یک ژن، پژوهشگران از چند RNA راهنما (sgRNA) استفاده میکنند تا نواحی مختلفی از ژن موردنظر را هدف بگیرند. این رویکرد در بسیاری از زمینههای پژوهشی کاربرد دارد، از جمله:
-
ژنومیکس عملکردی (Functional Genomics)
-
آنالیز مسیرهای زیستی (Pathway Analysis)
-
داروشناسی و غربالگری دارویی (Drug Discovery and Screening)
✅ اضافه کردن ژن با استفاده از کریسپر (CRISPR Knock-in)
در صورتی که پس از ایجاد شکست دو رشتهای توسط Cas9، از مکانیسم ترمیم هدایتشده توسط همولوژی (HDR) استفاده شود، میتوان از این فرصت برای اضافه کردن قطعات DNA جدید یا ژنهای کامل به ژنوم میزبان استفاده کرد.
در این روش، پژوهشگران یک الگوی DNA (Donor Template) را همراه با sgRNA و Cas9 وارد سلول میکنند. این الگو دارای توالیهایی همولوگ در دو طرف قطعه ژنی مورد نظر است تا هنگام ترمیم، سلول بتواند از آن به عنوان راهنما استفاده کند.
استفاده موفق از HDR نیازمند زمانبندی دقیق، انتخاب مناسب مرحله چرخه سلولی، و طراحی صحیح توالی الگو است.
✅ تنظیم بیان ژن با استفاده از CRISPRa و CRISPRi
فناوری کریسپر را میتوان طوری مهندسی کرد که به جای ایجاد شکست در DNA، تنها باعث تنظیم بالا یا پایین بیان ژنها شود. این روش به دو شکل مختلف انجام میگیرد:
-
فعالسازی ژن (CRISPR Activation | CRISPRa):
افزایش بیان ژن با جذب فاکتورهای رونویسی به ناحیه پروموتر. -
مهار بیان ژن (CRISPR Interference | CRISPRi):
کاهش یا خاموشسازی بیان ژن با جلوگیری از اتصال RNA پلیمراز.
برای این هدف، از نوع خاصی از آنزیم Cas9 استفاده میشود که به آن Cas9 غیرفعال (Dead Cas9 | dCas9) میگویند. این آنزیم توانایی ایجاد برش در DNA را ندارد، اما میتواند به ناحیه هدف متصل شود و به همراه خود مولکولهای تنظیمکننده (Activator یا Repressor) را حمل کند.
این تکنیک برای مطالعه در زمینههای زیر کاربردی است:
-
زیستشناسی تکوینی
-
بیماریهای عفونی و مزمن
-
مطالعات مربوط به مقاومت دارویی
-
تحلیل عملکردی ژنوم
-
بررسی عناصر ژنتیکی دخیل در فنوتیپها
✅ غربالگری ژنتیکی با استفاده از کریسپر (CRISPR Screens)
فناوری کریسپر-Cas9 زمینهساز تحولی عظیم در غربالگری ژنومی در مقیاس بالا شده است. در این روش، با حذف یا فعالسازی ژنهای مختلف در سلولها و مشاهده اثرات حاصل، میتوان عملکرد ژنها را بررسی کرد و اهداف دارویی جدید را شناسایی نمود.
مراحل معمول غربالگری کریسپر به این صورت است:
-
طراحی و تولید کتابخانهای وسیع از sgRNAها که ژنهای مختلف را هدف میگیرند.
-
انتقال این کتابخانه به ردههای سلولی خاص.
-
تحلیل تغییرات فنوتیپی ایجادشده پس از ویرایش.
-
شناسایی ژنهایی که باعث بروز یا مهار بیماری یا مقاومت دارویی شدهاند.
در مقایسه با غربالگری RNAi، روش کریسپر دقت بالاتر، نوسان کمتر در دادهها، و ریسک کمتر حذف سلولهای مورد مطالعه را دارد. به همین دلیل، غربالگری کریسپر امروزه به عنوان روشی قابل اطمینان برای کشف عملکرد ژنها شناخته میشود.
✅ ویرایش پایه (Base Editing)
یکی از تکنولوژیهای توسعهیافته بر اساس کریسپر، ویرایش پایه است. در این روش، بدون نیاز به ایجاد شکست دو رشتهای در DNA، میتوان تغییرات نقطهای در نوکلئوتیدها ایجاد کرد.
ویرایش پایه از دو نسخه خاص از Cas9 استفاده میکند:
-
dCas9 (Cas9 غیرفعال): متصل میشود اما برش نمیزند.
-
nCas9 (Cas9 نیکاز): فقط یک رشته از DNA را میبرد (Single-Strand Break).
این آنزیمها به همراه آنزیمهای تغییردهنده نوکلئوتید، به ناحیه هدف هدایت میشوند و میتوانند تغییراتی مانند C→T یا A→G را در DNA ایجاد کنند.
اگرچه این روش بسیار دقیق است، اما محدودیتهایی دارد، از جمله:
-
فقط برخی تغییرات خاص در نوکلئوتیدها امکانپذیر است.
-
نیاز به وجود PAM مناسب در نزدیکی ناحیه هدف.
-
خطر ایجاد اثرات خارج از هدف (off-target) در صورت طراحی ضعیف gRNA.
✅ ویرایش پیشرفته (Prime Editing)
به منظور غلبه بر محدودیتهای ویرایش پایه، فناوری ویرایش پیشرفته (Prime Editing) توسعه یافت. در این تکنیک، Cas9 نیکاز با دو جزء کلیدی ترکیب میشود:
-
آنزیم نسخهبرداری معکوس مهندسیشده (Engineered Reverse Transcriptase)
-
RNA راهنمای ویرایش پیشرفته (pegRNA)
ساختار pegRNA شامل دو بخش است:
-
بخشی برای هدایت سیستم به توالی هدف.
-
بخشی حاوی توالی نوکلئوتیدی جایگزین که قرار است وارد DNA شود.
پس از برش رشته هدف توسط nCas9، آنزیم نسخهبرداری معکوس از اطلاعات pegRNA برای بازنویسی DNA استفاده میکند. سپس رشته مکمل نیز به کمک gRNA دوم و nCas9 برش خورده و ترمیم میشود.
کارایی و دقت این روش بسیار بالاست؛ بهطوریکه برخی تحقیقات نشان میدهند با ویرایش پیشرفته میتوان تا ۸۹٪ جهشهای ژنتیکی انسان را هدفگذاری و اصلاح کرد.
📊 جدول مقایسه ویرایش پایه و پیشرفته
|
ویژگی |
ویرایش پیشرفته (Prime Editing) |
ویرایش پایه (Base Editing) |
|---|---|---|
|
نوع جهش |
ایجاد، حذف و جایگزینی نوکلئوتید |
جایگزینی محدود نوکلئوتید |
|
انواع جهش قابل اعمال |
هر چهار نوع جهش نقطهای (Purine↔Pyrimidine) |
معمولاً دو نوع تغییر پایهای |
|
ایجاد شکست در DNA |
نیاز به شکست تکرشتهای |
بدون شکست دو رشتهای |
|
دقت و قابلیت پیشبینی |
بسیار بالا و پایدار |
بالا ولی محدود به نوع جهش |
|
طول توالی قابل ویرایش |
حذف تا ۸۰ و اضافه تا ۴۵ جفت باز |
معمولاً تغییرات محدود در یک نوکلئوتید |
|
نیاز به HDR |
ندارد |
ندارد |
|
مزایا |
انعطاف بالا، مناسب درمان |
سادگی، سرعت، بدون شکست دو رشتهای |
⚙️ دستهبندی سیستمهای CRISPR-Cas9
سیستمهای CRISPR-Cas بر اساس ساختار پروتئینهای Cas به دو دسته اصلی تقسیم میشوند:
-
Class I: شامل انواع ۱، ۳ و ۴
-
Class II: شامل انواع ۲، ۵ و ۶
در کاربردهای رایج زیستفناوری، سیستم Class II نوع ۲ (که همان CRISPR-Cas9 است) بیشتر مورد استفاده قرار میگیرد؛ چرا که ساختار سادهتر و انتقالپذیری بالاتری دارد.
اجزای اصلی سیستم CRISPR-Cas9: آشنایی دقیق با Cas9، RNA راهنما و توالی PAM
در بخش نخست گفتیم که دو جزء اصلی سیستم کریسپر شامل RNA راهنما و پروتئین Cas9 هستند. اما برای درک کامل و بهکارگیری صحیح این فناوری در آزمایشگاه، تنها شناخت این دو مولکول کافی نیست. در مولکول DNA نیز توالیهایی وجود دارند که در عملکرد این سیستم نقش حیاتی دارند. یکی از این توالیها، توالی PAM است که در بخشهای قبل به آن اشاره کردیم و در ادامه بهطور مفصل بررسی خواهیم کرد.
پروتئینهای Cas: آنزیمهای اندونوکلئاز با تنوع عملکردی بالا
پروتئینهای Cas گروهی از آنزیمهای اندونوکلئاز هستند که در آرکیها و باکتریها یافت شدهاند و نقش کلیدی در سیستم ایمنی تطبیقی آنها دارند. از میان انواع مختلف پروتئینهای Cas، آنزیم Cas9 شناختهشدهترین و پرکاربردترین نوع در زیستفناوری است. با این حال، در طراحی سیستمهای ویرایش ژنوم، انتخاب مناسبترین نوع Cas با توجه به هدف پروژه، اهمیت بسیار زیادی دارد. انتخاب اشتباه میتواند باعث کاهش دقت یا اثربخشی فرآیند ویرایش ژنوم شود.
Cas9: قیچی ژنتیکی با ساختار پیچیده و عملکرد دقیق
پروتئین Cas9 اولین نوع شناختهشده از خانواده Cas است که ساختار آن شامل ۱۳۶۸ آمینواسید است. این آنزیم بزرگ و چنددامنهای از دو لوب اصلی تشکیل شده است:
-
لوب شناساگر (Recognition | REC):
-
شامل دومینهای REC1 و REC2 است.
-
وظیفه اصلی آن، شناسایی و اتصال به RNA راهنماست.
-
-
لوب نوکلئازی (Nuclease | NUC):
-
دارای سه دومین مهم به نامهای RuvC، HNH و دومین تعاملکننده با توالی PAM است.
-
دومینهای RuvC و HNH هرکدام یک رشته از DNA را برش میدهند.
-
دومین PAM-binding وظیفه شناسایی توالی PAM را برعهده دارد و اتصال اولیه آنزیم به DNA را تنظیم میکند.
-
RNA راهنما: طراحی هدفمند برای هدایت Cas9
RNA راهنما (gRNA) نیز مانند Cas9، نقش محوری در سیستم دارد و به دو بخش ساختاری تقسیم میشود:
-
CRISPR RNA (crRNA):
-
دارای حدود ۱۸ تا ۲۰ جفت باز است.
-
این توالی مکمل ناحیهای از DNA هدف بوده و مسئول جفت شدن با آن است.
-
-
Trans-Activating CRISPR RNA (tracrRNA):
-
رشتهای بلند با ساختارهای لوپی متعددی است.
-
وظیفه آن فراهم کردن جایگاه اتصال برای Cas9 است.
-
در موجودات پروکاریوتی، این دو RNA بهطور طبیعی جدا از هم عمل میکنند، اما در کاربردهای آزمایشگاهی، آنها را بهصورت یک RNA مصنوعی تکرشتهای به نام sgRNA (single guide RNA) ترکیب میکنند. این طراحی به پژوهشگران این امکان را میدهد که ژن خاصی را بهطور دقیق هدف قرار دهند و قابلیت تنظیم گستردهای را فراهم میسازد.
توالی PAM: کلید اتصال و فعالیت Cas9
اگرچه سیستم CRISPR-Cas9 DNA هدف را بر اساس مکمل بودن با crRNA شناسایی میکند، اما بدون وجود یک توالی کوتاه به نام PAM (Protospacer Adjacent Motif)، Cas9 قادر به اتصال و انجام برش نخواهد بود. این توالی معمولاً ۲ تا ۶ نوکلئوتید دارد و بسته به نوع آنزیم Cas میتواند متفاوت باشد (برای مثال: NGG در Cas9 مشتق از S. pyogenes).
اهمیت توالی PAM در این است که:
-
تنها در حضور آن، Cas9 به DNA متصل شده و فرآیند برش آغاز میشود.
-
عدم حضور PAM در ناحیه مکمل crRNA باعث میشود Cas9 به آن توالی حمله نکند، حتی اگر crRNA کاملاً مکمل باشد.
مراحل کاربردی استفاده از CRISPR-Cas9 در آزمایشگاه
1. انتخاب ژن هدف و اندونوکلئاز مناسب
نخستین گام در طراحی یک آزمایش ویرایش ژنوم با سیستم کریسپر، انتخاب ژن هدف و نوع تغییری است که قصد ایجاد آن را داریم. سپس توالی دقیق ژن را از پایگاههایی مانند NCBI یا EMBL استخراج میکنیم. برای بررسی کامل، توصیه میشود بخشهایی از توالیهای بالادست و پاییندست ژن نیز در نظر گرفته شوند تا احتمال یافتن توالی PAM در موقعیت مناسب افزایش یابد.
نکته مهم این است که انتخاب نوع آنزیم Cas باید متناسب با هدف آزمایش باشد. برای مثال:
-
Cas9 برای ایجاد برشهای دو رشتهای و حذف ژنها بسیار مناسب است.
-
آنزیمهایی مانند Cas12 یا Cas13 کاربردهای متفاوتی دارند و در شرایط خاص کارآیی بهتری دارند.
2. طراحی gRNA مناسب
طراحی دقیق gRNA یکی از حساسترین مراحل اجرای موفق کریسپر است. نرمافزارهای مختلفی برای این منظور وجود دارند، از جمله:
-
Benchling
-
GenScript
-
E-CRISP
-
ATUM
-
CRISPR Design (MIT)
در این نرمافزارها، پس از بارگذاری توالی DNA، پیشنهاداتی برای gRNA مناسب ارائه میشود که شامل موارد زیر است:
-
طول gRNA (معمولاً ۲۰ نوکلئوتید برای Cas9)
-
موقعیت توالی نسبت به PAM
-
امتیاز طراحی (۰ تا ۱۰۰) برای حذف یا درج ژن
نمره بالا (نزدیک به ۱۰۰) نشاندهنده کارآیی بالا و اختصاصیت خوب است، در حالی که نمره پایین ممکن است به دلیل تشابه توالی با سایر نواحی ژنومی و خطر اتصالات غیراختصاصی باشد.
فاکتورهای مؤثر بر کارآیی sgRNA:
-
درصد GC (محتوای سیتوزین و گوانین)
-
طول مناسب توالی
-
ساختار ثانویه (نبود لوپهای مزاحم)
-
توالیهای تکراری یا ناقص
3. بررسی امکان درج gRNA در وکتور بیان
پس از انتخاب gRNA، گام بعدی بررسی وکتور مناسب برای انتقال این توالی به سلول هدف است. در نرمافزارهایی مثل Benchling میتوان با گزینه «Assemble» توالی gRNA را در کنار انواع وکتورهای موجود بررسی کرد. نکات مهم در انتخاب وکتور:
-
قابلیت پذیرش توالی gRNA
-
مناسب بودن برای سلول هدف (مثلاً سلول انسانی، باکتری، مخمر)
-
وجود ژن Cas9 در همان وکتور (یا جداگانه)
-
آنزیمهای محدودکننده مناسب برای درج gRNA
اگر درگاههای مناسب و آنزیمهای لازم برای برش و چسبندگی در دسترس باشند، میتوان وارد مرحله عملی شد و gRNA را به وکتور اضافه کرد.
4. روشهای مختلف بیان gRNA در سلول
دو رویکرد رایج برای بیان gRNA و Cas9 در سلول وجود دارد:
-
کلونینگ gRNA و Cas9 در وکتور بیان:
شامل استفاده از آنزیمهای محدودکننده، DNA لیگاز، بافر مناسب، پیپت و سایر ابزارهای آزمایشگاهی. -
بیان مستقیم از mRNA سنتزی:
در این روش، ابتدا RNA پلیمراز خاصی در لولههای آزمایشگاهی، gRNA و Cas9 را به صورت mRNA سنتز میکند. سپس این مولکولها مستقیماً به سلول هدف منتقل میشوند. این روش برای سلولهای غیرتقسیمی یا حساس مناسبتر است و از کلونینگ پرهزینه جلوگیری میکند.
5. ایجاد برش در ژن هدف
پس از ورود وکتور بیان (یا mRNA سنتزی) به سلول، سیستم CRISPR وارد مرحله اجرا میشود. بیان gRNA و Cas9 منجر به تشکیل کمپلکس فعال و شناسایی توالی هدف در DNA خواهد شد. پس از اتصال صحیح و شناسایی توالی PAM، Cas9 هر دو رشته DNA را در موقعیت مشخص برش میدهد.
برای ارزیابی عملکرد سیستم، سلولها باید مدتی در انکوباتور رشد کرده و کلنیسازی شوند. سپس با استفاده از روشهایی مانند PCR یا توالییابی، میتوان بررسی کرد که آیا ویرایش ژنوم با موفقیت انجام شده است یا خیر.
محدودیتهای کاربردی سیستم CRISPR-Cas9
با وجود قدرت و انعطافپذیری بالا، استفاده از کریسپر محدودیتها و چالشهایی نیز دارد:
-
برشهای غیراختصاصی (Off-target effects):
ممکن است gRNA به توالیهایی با شباهت جزئی متصل شود و باعث جهشهای ناخواسته گردد. -
ضرورت وجود توالی PAM:
عدم وجود PAM در موقعیت مناسب مانع از عملکرد Cas9 میشود. -
سمیت ناشی از آسیب DNA:
برشهای دو رشتهای میتوانند مسیرهای مرگ سلولی (apoptosis) را فعال کنند. -
فعال شدن سیستم ایمنی انسان:
بهویژه در مطالعات بالینی، ورود Cas9 با منشأ باکتریایی ممکن است منجر به پاسخهای ایمنی شود. -
چالش در رساندن سیستم به سلول هدف:
برخی سلولها (مانند سلولهای بنیادی یا عصبی) انتقالپذیری پایینی دارند و نیازمند روشهای خاصی هستند.
توالی PAM: کلید اتصال Cas9 به DNA هدف
توالی PAM (Protospacer Adjacent Motif) معمولاً دارای طولی بین ۲ تا ۶ نوکلئوتید است و بر روی رشتهای از DNA قرار دارد که مکمل crRNA نیست و در ناحیه پاییندست توالی هدف قرار میگیرد.
اهمیت این توالی در عملکرد سیستم کریسپر بسیار حیاتی است؛ زیرا اگر توالی PAM وجود نداشته باشد، آنزیم Cas9 نهتنها قادر به اتصال به DNA هدف نخواهد بود، بلکه نمیتواند شکست دو رشتهای در آن ایجاد کند. در واقع، توالی PAM بهعنوان پیشنیاز شناسایی DNA هدف عمل میکند.
توالی جداکننده (Spacer) و توالی مکمل آن در سیستم ایمنی باکتریها
در معرفی کریسپر بهعنوان سیستم ایمنی تطبیقی باکتریها، اشاره کردیم که با ورود ژنوم بیگانه به درون سلول باکتریایی، بخشی از این ژنوم بهعنوان «توالی جداکننده» یا Spacer از آن جدا شده و در جایگاه ژنی CRISPR که بر روی ژنوم باکتری قرار دارد، درج میشود.
این توالی جداکننده معمولاً حدود ۲۰ نوکلئوتید طول دارد. پس از ادغام در ناحیه CRISPR ژنوم باکتری، با هر بار رونویسی از این ناحیه، RNA راهنما تولید میشود. این RNA، که مکمل ژنوم بیگانه است، در شناسایی و نابودی آن توسط باکتری نقش ایفا میکند. این بخش مهم، مبنای طراحی RNA راهنما برای کاربردهای آزمایشگاهی نیز بهشمار میرود.
اجزای مولکولی سیستم CRISPR-Cas9 و وظایف آنها
در جدول زیر اجزای مختلف Cas9 و RNA راهنما را بههمراه ساختار و عملکرد آنها مشاهده میکنیم:
|
مولکول |
اجزای ساختاری |
وظایف هر جزء |
|---|---|---|
|
Cas9 |
لوب شناسایی (REC1 و REC2) |
شناسایی محل توالی هدف روی DNA |
|
|
لوب نوکلئازی (RuvC، HNH، PI) |
RuvC و HNH مسئول برش دو رشته DNA، PI مسئول شناسایی توالی PAM |
|
RNA راهنما |
crRNA |
انتهای '۵ مکمل توالی هدف؛ انتهای '۳ برای اتصال به Cas9 و tracrRNA |
|
|
tracrRNA |
اتصال به Cas9 و تشکیل کمپلکس فعال |
اثرات ناخواسته (Off-Target Effects) در ویرایش ژنوم
یکی از چالشهای مهم در استفاده از تکنولوژی CRISPR-Cas9، خطر ایجاد شکست در نواحی ناخواسته از ژنوم است. این اثرات که به آنها Off-Target گفته میشود، میتوانند باعث ایجاد جهشهای غیرهدف شوند. برای کاهش این اثرات:
-
از Cas9های مهندسیشده مانند Cas9 Nickase (Cas9n) استفاده میشود که بهجای شکست دو رشتهای، فقط یک رشته را برش میدهد.
-
از نسخههای دقیقتر Cas9 مانند SpCas9-HF1، evoCas9، HiFiCas9 و Cas9_R63A/Q768A استفاده میشود.
بهینهسازی طراحی RNA راهنما نیز نقش مهمی دارد. نکاتی که باید در طراحی sgRNA رعایت شوند:
-
Seed Sequence: بخشی از sgRNA در نزدیکی PAM با طول حدود ۱۰ تا ۱۲ باز
-
محتوای GC: درصد بازهای گوانین و سیتوزین در gRNA
-
اصلاح ساختاری sgRNA: مانند کوتاهسازی انتهای '۵ آن برای افزایش دقت اتصال
محدودیت ناشی از حضور PAM در توالی هدف
تکنولوژی کریسپر وابسته به وجود توالی PAM در نزدیکی ژن هدف است. هر نوع آنزیم Cas، توالی PAM خاصی را تشخیص میدهد.
-
برای SpCas9 (از Streptococcus pyogenes)، توالی PAM از '۵ به '۳ بهشکل NGG است.
-
این آنزیم حجیم است و وارد کردن آن به وکتورهایی مانند AAV دشوار است.
در مقابل:
-
SaCas9 (از Staphylococcus aureus) نسخه کوچکتری است و راحتتر در AAV قرار میگیرد اما به توالی PAM طولانیتری نیاز دارد:
-
NNGRRT یا NNGRR
-
تغییراتی که بر روی SaCas9 اعمال شدهاند، دامنه شناسایی PAM را افزایش دادهاند:
-
KKH SaCas9: شناسایی ۵′NNNRRT۳′
-
SpCas9-NG: شناسایی ۵′NG۳′
-
xCas9: شناسایی PAMهای متنوعی چون NG، GAA و GAT
تحقیقات نشان دادهاند که xCas9 کمترین میزان اثرات ناخواسته را در سلولهای انسانی ایجاد میکند.
سمیت ناشی از آسیب به DNA
ایجاد شکست دو رشتهای DNA توسط Cas9 میتواند باعث بروز عوارضی در سلول شود:
-
در سلولهای بنیادی پرتوان: فعالسازی p53 معمولاً منجر به آپوپتوز میشود.
-
در سلولهای سرطانی: مهار p53 ممکن است باعث بقای سلولهای آسیبدیده شود.
-
حذف ناخواسته DNA: حذفهای چند کیلوبازی و ترمیمهای نادرست ممکن است در درمانهای ژنی خطرناک باشند.
برای کاهش این عوارض:
-
از آنزیم dCas9 استفاده میشود که بدون برش DNA، بیان ژن را تغییر میدهد.
-
روشهای ویرایش پیشرفته و اولیه مانند Prime Editing معرفی شدهاند تا بدون شکست دو رشتهای، ویرایش دقیقتری فراهم شود.
واکنش سیستم ایمنی بدن به اجزای کریسپر
یکی از محدودیتهای بالینی دیگر، واکنش ایمنی بدن انسان نسبت به Cas9 است. چون این پروتئین منشأ باکتریایی دارد، ممکن است سیستم ایمنی آن را شناسایی کرده و با تولید آنتیبادی آن را حذف کند.
برای مقابله با این مشکل:
-
از ایزومرهای مهندسیشده Cas استفاده میشود.
-
سعی در کاهش ایمونوژنیسیته وکتورهای حامل (مانند AAV) انجام میگیرد.
دقت ویرایش ژن با استفاده از کریسپر
دو مسیر ترمیمی مهم در سلولهای انسانی:
-
NHEJ: رایجترین و سریعترین مسیر ترمیم، اما غیردقیق است.
-
HDR: با دقت بالا اما کارآیی پایین و وابسته به سیکل سلولی
برای استفاده از HDR باید ابتدا مسیر NHEJ را مهار کرد که چالشبرانگیز است.
کاربردهای فناوری CRISPR در زیستفناوری و پزشکی
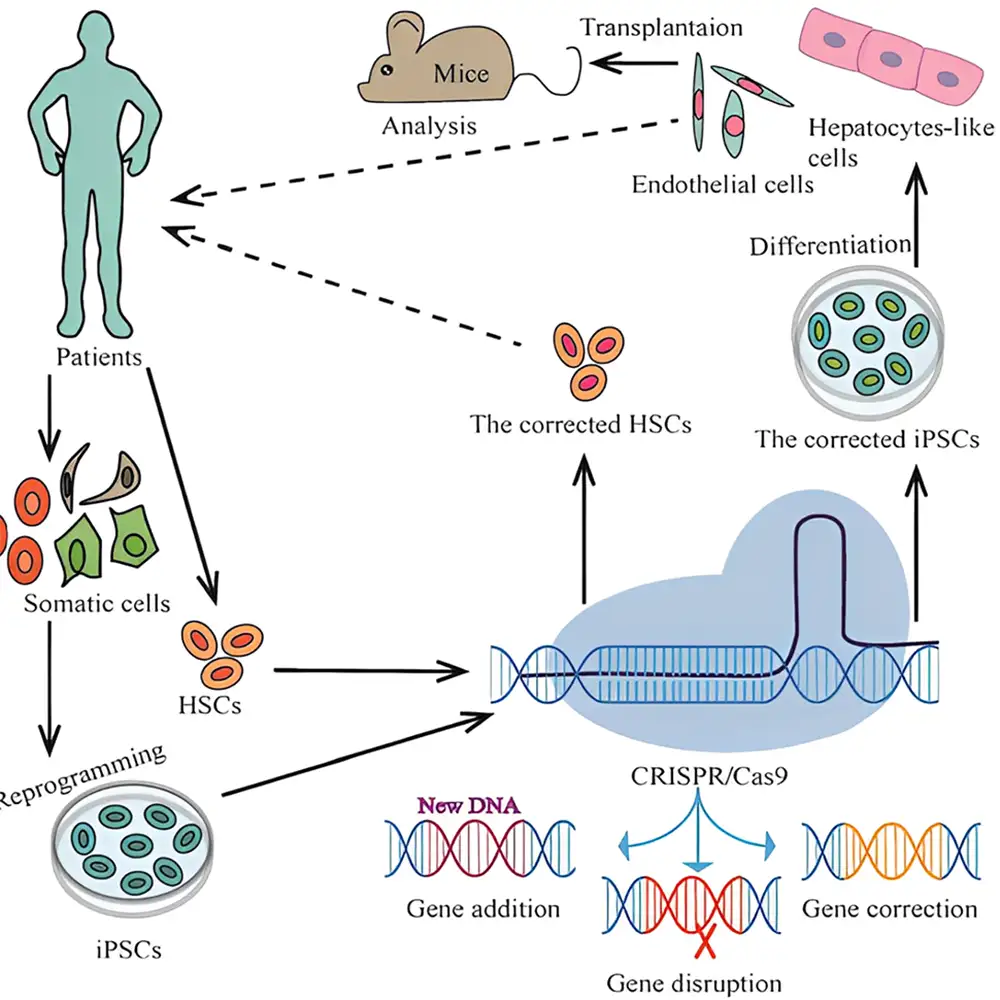
✅ سلولدرمانی و ژندرمانی
-
درمان بیماریهای ژنتیکی مانند:
-
زوال عصبی (Neurodegenerative Disorders)
-
اختلالات خونی (Blood Disorders)
-
سرطان
-
بیماریهای چشمی (Ocular Diseases)
-
در سال ۲۰۱۹، برای نخستینبار در بیماران مبتلا به کمخونی داسیشکل، سلولدرمانی با استفاده از کریسپر انجام شد. با بازگردانی هموگلوبینهای جنینی، عملکرد ژن معیوب بزرگسالان جبران شد.
✅ تشخیص بیماریها
-
در بیماریهای ویروسی نظیر COVID-19، از کریسپر برای شناسایی سریع و دقیق ژنوم ویروس استفاده میشود.
✅ کشاورزی
-
اصلاح ژنتیکی گیاهان برای مقاومت در برابر:
-
خشکسالی
-
آفات
-
بیماریهای قارچی و ویروسی
-
✅ انرژی زیستی
-
تولید بیودیزل: با افزایش تولید لیپید در جلبکها از طریق حذف فاکتورهای مهارکننده رونویسی
-
افزایش تحمل مخمرها: برای محیطهای سخت هنگام تولید اتانول
-
تقویت عملکرد باکتریها در تولید بیواتانول
جمع بندی:
در طول دهه گذشته، کریسپر (CRISPR) دنیای زیستپزشکی و علوم زیستی را به دلیل تواناییاش در ویرایش آسان و دقیق DNA، متحول کرده است.
-
کریسپر چیست؟
-
چگونه کار میکند؟
-
ژندرمانی و سلولدرمانی چیستند و کریسپر چه نقشی در آنها دارد؟
-
چه تفاوتی با دیگر ابزارهای ویرایش ژن دارد؟
-
چرا اینقدر اهمیت دارد؟
-
فناوری کریسپر از زمان ابداعش چقدر پیشرفت کرده است؟
-
در سال ۲۰۱۹، ویکتوریا گری اولین فرد در ایالات متحده بود که برای یک بیماری ژنتیکی (کمخونی داسیشکل) تحت درمان با کریسپر قرار گرفت. اکنون، درمانهای مبتنی بر کریسپر در آمریکا و بریتانیا تأیید شدهاند. گام بعدی چیست؟
-
به غیر از درمان بیماریها، دیگر کاربردهای واقعی فناوری کریسپر چیست؟
-
برخی از نگرانیهای اخلاقی پیرامون کریسپر چیست؟
-
آیا محدودیتی برای آنچه کریسپر میتواند انجام دهد وجود دارد؟
-
کریسپر در آینده قادر به انجام چه کارهایی خواهد بود؟
۱. کریسپر چیست؟
پاسخ کوتاه: کریسپر یک سیستم ایمنی است که توسط میکروبها برای یافتن و از بین بردن مهاجمان ناخواسته استفاده میشود.
توضیح : کریسپر (CRISPR) مخفف «تناوبهای کوتاه پالیندرومیک فاصلهدار منظم خوشهای» است. زیستشناسان از این اصطلاح برای توصیف «ظاهر ژنتیکی» سیستمی استفاده میکنند که در میکروبها - از جمله باکتریها و آرکیها - در اوایل سال ۱۹۸۷ کشف شد. برای مدت طولانی، هیچکس واقعاً نمیدانست چه کاری انجام میدهد، اما در حدود سال ۲۰۰۵، محققان کشف کردند که کریسپر یک سیستم ایمنی است. این سیستم توسط میکروبها استفاده میشود تا به آنها کمک کند از خود در برابر ویروسهای مهاجم محافظت کنند. برای متوقف کردن مهاجمان، میکروبها از کریسپر برای شناسایی و حذف متجاوزان خاص استفاده میکنند.
۲. چگونه کار میکند؟
پاسخ کوتاه: وقتی یک ویروس یا مهاجم دیگری وارد سلول باکتری میشود، باکتری بخشی از DNA متجاوز را در ژنوم خود ادغام میکند تا بتواند در عفونتهای آینده ویروس را پیدا کرده و از بین ببرد.
توضیح : این فرآیند شبیه به سیستم ایمنی انسان است. وقتی ویروسی ما را آلوده میکند، ما یک حافظه ایمنی به شکل آنتیبادیها – به تعداد زیاد – تولید میکنیم. سپس، وقتی همان ویروس دوباره ما را آلوده کند، این آنتیبادیها به سرعت مهاجمان را شناسایی کرده و آنها را از بین میبرند.
وقتی ویروسی یک سلول باکتری را آلوده میکند، کریسپر به ایجاد یک حافظه – از نوع ژنتیکی – کمک میکند. باکتری قطعهای از ژنوم ویروس را برداشته و آن DNA را در ژنوم خود وارد میکند. از آن توالی DNA تازه به دست آمده، کریسپر یک «RNA راهنما» جدید میسازد؛ توالیای که به کریسپر کمک میکند تا مهاجم را از طریق مکمل بودن توالیها پیدا کند (یعنی A به T و C به G متصل میشود). بنابراین، دفعه بعد که ویروس آن سلول باکتری را آلوده کند، RNA راهنما به سرعت توالی DNA ویروس را شناسایی کرده، به آن متصل میشود و آن را از بین میبرد.

۳. ژندرمانی و سلولدرمانی چیستند و کریسپر چه نقشی در آنها دارد؟
پاسخ کوتاه: ژندرمانی میتواند به معنای استفاده از کریسپر به عنوان یک داروی ماکرومولکولی برای ترمیم یک ژن جهشیافته یا تنظیم یک ژن معیوب به منظور درمان یک بیماری باشد. سلولدرمانی به معنای استفاده از کریسپر برای وادار کردن سلولهای بدن به حمله به سلولهای سمی یا بازسازی سلولهای مفید است.
توضیح : ژندرمانی میتواند دو معنا داشته باشد: یکی ترمیم یک ژن جهشیافته، و دیگری تنظیم بیان (expression) یک ژن برای تولید محصولات پروتئینی. درک کنونی ما از ژندرمانی هنوز به سرعت در حال پیشرفت است و چالش اصلی، مدیریت ایمن و ارزان این درمان است. علاوه بر این، ما تنها در حال بررسی سادهترین بیماریهای ژنتیکی هستیم. به عنوان مثال، کمخونی داسیشکل بیماریای است که اطلاعات زیادی در مورد آن داریم و اغلب توسط یک جهش منفرد ایجاد میشود. بنابراین، میتوانیم کریسپر را برای ترمیم آن پیکربندی کنیم. اما بیماریهای بسیار بیشتری وجود دارند که توسط جهشهای گسترده، جهشهای چندگانه و حتی چندین ژن ایجاد میشوند. در آینده، ژندرمانی میتواند فراتر از یک جهش منفرد عمل کند، و من خوشبینم که در دهههای آینده، ژندرمانی به یکی از ارکان اصلی پزشکی تبدیل خواهد شد.
بهکارگیری علم ساده برای حل مشکلات پیچیده
تکرارهای خوشهبندیشده منظم و پالیندرومی در فاصلههای کوتاه یا به اختصار CRISPR (کریسپر)، نوعی ساختار خاص در DNA است. در این خوشهها، توالیهایی وجود دارند که دقیقاً همین ویژگی را دارند: بهصورت منظم در کنار هم قرار گرفتهاند، پالیندرومی هستند (یعنی از جلو و عقب به یک شکل خوانده میشوند) و تکراری هستند. بین این توالیهای تکراری، فاصلهگذارهایی وجود دارد که کاملاً شبیه توالی ویروسهایی به نام باکتریوفاژ هستند، یعنی ویروسهایی که باکتریها را آلوده میکنند.
CRISPR در اصل یک سیستم دفاعی در باکتریها است که از آنها در برابر حمله باکتریوفاژها محافظت میکند. وقتی یک ویروس به باکتری حمله میکند، سیستم CRISPR مواد ژنتیکی ویروس را بررسی میکند و اگر تشخیص دهد که دشمن است، آن را هدف قرار میدهد و از کار میاندازد. با گذشت زمان، باکتریها این سیستم دفاعی را بهروزرسانی میکنند تا تهدیدهای گذشته را به یاد بسپارند و در مواجهه مجدد سریعتر آنها را نابود کنند.
دانشمندان توانستهاند از این سیستم دفاعی طبیعی باکتریها بهره ببرند و از آن بهعنوان «قیچی ژنتیکی» استفاده کنند. به این معنا که CRISPR میتواند دقیقاً یک بخش خاص از DNA را هدف گرفته و یا آن را غیرفعال کند، یا ماده ژنتیکی جدیدی را در آن جایگزین کند.
درمان سلولی کمی متفاوت است. برای مثال، زمانی که افراد تلاش میکنند لوسمی، نوعی تومور گلبولهای سفید خون، را درمان کنند، گاهی اوقات داروهای شیمیدرمانی نمیتوانند به طور کامل سلولهای تومور را از بین ببرند. در دو دهه گذشته، دانشمندان دریافتهاند که اگر برخی از سلولهای T بیمار را که با عفونتها مبارزه میکنند، بازیابی کنند، این سلولها را میتوان به گونهای مهندسی کرد که به مبارزان بهتری برای شناسایی و از بین بردن سلولهای توموری تبدیل شوند. وقتی سلولهای T اصلاح شده به بیمار تزریق میشوند، میتوانند به تومورها حمله کنند. با این حال، سلولها کاملاً پیچیده هستند. گاهی اوقات، پس از تزریق مجدد به بیمار، از کنترل خارج شده و سلولهای سالم را همراه با سلولهای تومور از بین میبرند. در مواقع دیگر، ممکن است به دلیل سرکوب شدن توسط سلولهای تومور نتوانند عمل کنند. CRISPR ابزاری قدرتمند برای افزایش اثربخشی و ایمنی این سلولهای ایمنی ارائه میدهد تا آنها برای بهترین منافع بالینی کاملاً تحت کنترل ما باشند.
۴. CRISPR چگونه با سایر ابزارهای ویرایش ژن تفاوت دارد؟
پاسخ کوتاه: برنامهریزی CRISPR بسیار آسانتر از سایر ابزارها است.
قبل از CRISPR، بیشتر ابزارهای ویرایش ژن یک پروتئین واحد بودند. دانشمندان با تغییر توالی پپتیدی این پروتئینها میتوانستند اهدافشان را تغییر دهند. برای تغییر هدف، باید توالی پروتئین را به طور کامل بازطراحی کرده و سپس آزمایش میکردید که آیا اصلاً کار میکند یا خیر، که این طاقتفرسا، غیرقابل پیشبینی و زمانبر بود. این ابزارهای ویرایش ژن از نظر تئوری جالب بودند، اما استفاده از آنها برای مطالعات در مقیاس بزرگ و درمانها دشوار بود.
در مقایسه با آن، CRISPR زیباست زیرا توالی شناسایی هدف عمدتاً در RNA رمزگذاری شده است تا در پروتئین، و بازطراحی این توالی یکی از سادهترین کارهایی است که میتوانید در زیستشناسی مولکولی انجام دهید. این باعث میشود ویرایش ژنوم شبیه به کار با GPS باشد: اگر میخواهید به مقصد A بروید، فقط آدرس را تایپ میکنید، و برای تغییر به مقصد B، فقط مکان جدید را وارد میکنید. بنابراین، این ابزار به طرز چشمگیری بار کاری، هزینه، و زمان را کاهش داده، در حالی که دقت و صحت یک سیستم ویرایش ژن را افزایش میدهد. بازگشت به لیست سوالات
۵. چرا CRISPR تا این حد مهم است؟
پاسخ کوتاه: CRISPR میتواند با دقت یک قطعه از DNA یا شیمی آن (که به آن اپیژنتیک میگویند) را در بدن انسان اصلاح کند، و آن را به ابزاری بالقوه برای استفادههای بالینی در علوم زیستپزشکی تبدیل کند.
CRISPR یک مولکول و ابزاری است که مورد تقاضای هر کسی است که در علوم زیستی، تحقیقات زیستپزشکی و محیطهای بالینی کار میکند. دقت بالای آن بینظیر است و امکان استفادههای بسیاری از جمله ژندرمانی را فراهم میکند.
رویای من همیشه توسعه بیوتکنولوژیهای جدید و به کارگیری آنها در بیماریهایی بوده است که درمانی ندارند. بیماریهای ژنتیکی بخش بزرگی از این دسته را تشکیل میدهند. داروهای سنتی – داروهای مولکول کوچک، جراحی و سایر روشها – برای این نوع بیماریها کارساز نیستند. اما مولکولهای CRISPR به عنوان درمانها بسیار امیدوارکننده شدهاند زیرا به ما امکان میدهند یک قطعه DNA را در بدن انسان به طور دقیق اصلاح کنیم. این میتواند نه تنها به تسکین، بلکه به درمان منجر شود.
در واقع، تأیید اخیر FDA برای اولین داروی CRISPR، Casgevy، در درمان کمخونی داسیشکل و بتا تالاسمی، گویای ایمنی و پتانسیل آن برای سایر بیماریها است. کمخونی داسیشکل بیماریای است که در آن افراد جهشی در گلبولهای قرمز خون خود دارند. به طور معمول، هیچ درمانی به جز انتقال خون مکرر یا پیوند مغز استخوان از یک دهنده سازگار وجود ندارد، که هر دو گران و برای سلامت کلی بیمار مضر هستند. با استفاده از CRISPR، میتوان یک درمان یکباره برای تصحیح دائمی جهش انجام داد. بیش از ۸۰۰۰ بیماری ژنتیکی مشابه وجود دارد که به طور بالقوه میتوانند در نظر گرفته شوند.
۶. فناوری CRISPR از زمان ایجاد آن تا کجا پیشرفت کرده است؟
پاسخ کوتاه: در حدود یک دهه، دانشمندان از اینکه آیا این فناوری اصلاً در سلولهای انسانی کار میکند یا خیر، به دریافت اولین داروی CRISPR که برای استفاده در کلینیک تأیید شده، رسیدند.
در اوایل، کاربرد عملی CRISPR چندان مورد توجه عمومی قرار نگرفته بود. در آن زمان، بسیاری از استدلالهای مخالف میگفتند که CRISPR فقط یک سیستم باکتریایی است و بیشتر آنها به سادگی در سلولهای انسانی کار نمیکنند – که البته، منصفانه بگوییم، این درست است.
اما پس از آنکه جنیفر دودنا و امانوئل شارپنتیه مقاله مهم خود در سال ۲۰۱۲ را در مورد Cas9 – یک نوع از CRISPR که DNA را با استفاده از یک پروتئین واحد و یک RNA راهنمای منفرد مهندسیشده برش میدهد – منتشر کردند، تحقیقات و مقالات منتشر شده به طور تصاعدی رشد کرد. اولاً، به این دلیل که این سیستمی است که هر کسی در علوم زیستی آن را میخواهد. ثانیاً، استفاده از CRISPR فوقالعاده آسان، انعطافپذیر و قوی است. این مانند سایر فناوریهایی نیست که راهاندازی آنها چندین سال و میلیونها دلار هزینه داشته باشد – راهاندازی CRISPR اکنون تنها چند هفته و کمی بیش از چند صد دلار طول میکشد.
بسیاری از محققان به سرعت توسعه آن کمک قابل توجهی کردند. برای مثال، ظرف سه سال پس از اولین نمایش اولیه آن، زیستشناسان ساختاری، ساختار سهبعدی با وضوح بالا از ظاهر Cas9 و سایر پروتئینهای CRISPR را حل کردند. متخصصان بیوانفورماتیک بسیاری از گونههای جدید مولکولهای Cas را فراتر از Cas9 کشف کردهاند که بسیاری از آنها عملکردهای جدیدی دارند. بیوشیمیدانها CRISPR را مهندسی کردند تا بفهمند چقدر سریع و محکم به DNA متصل میشود. مهندسان زیستی پروتئینها را مهندسی کردند تا آنها را کارآمدتر و خاصتر کنند تا بتوانند برای ژندرمانی در بدن انسان بهتر عمل کنند. همچنین، محققان بالینی شروع به استفاده از این ابزار برای پرداختن به بیماریهای خاص کردند.
علاوه بر این، کاربردهای CRISPR فراتر از ویرایش ژن رفت. ویرایش اپیژنتیک یک پیشرفت هیجانانگیز است، هرچند ما هنوز منتظر فواید بالینی آن هستیم. از آن برای هدف قرار دادن ژنوم سهبعدی انسان، تجسم دینامیک DNA، یا حتی هدف قرار دادن مجموعهای دیگر از مولکولها، RNA، برای تنظیم ژن استفاده شد.
فکر نمیکنم اغراق باشد اگر بگویم که، اساساً، CRISPR به عنوان یک گزینه درمانی بالقوه برای هر بیماری که دانش روشنی درباره آن داریم، آزمایش شده است. CRISPR نمیتواند همه آنها را حل کند، اما چون این ابزار بسیار قدرتمند، آسان برای استفاده و بسیار گسترده است، به همه اجازه داده است تا تخصص خود را با CRISPR ترکیب کنند.
۷. در سال ۲۰۱۹، ویکتوریا گری اولین فردی در ایالات متحده بود که برای یک بیماری ژنتیکی (کمخونی داسیشکل) درمان CRISPR دریافت کرد. اکنون، درمانهای مبتنی بر CRISPR در ایالات متحده و انگلستان تأیید شدهاند. گام بعدی چیست؟
پاسخ کوتاه: این بسیار هیجانانگیز است. داروهای CRISPR آینده به بیماریهای لاعلاج بیشتری خواهند پرداخت، که یک مورد آزمایشی برای اثربخشی و ایمنی CRISPR در اندامها و بیماران مختلف فراهم میکند.
زمانی که CRISPR برای اولین بار عرضه شد، نگرانیهایی در مورد اینکه آیا این مولکولهای باکتریایی را میتوان با خیال راحت در انسان استفاده کرد و آیا برش و ویرایش DNA انسانی ایمن است، وجود داشت. در حالی که هنوز سؤالاتی در مورد اثرات بلندمدت (فراتر از دوره کارآزماییهای بالینی در بیماران آزمایش شده) وجود دارد، بسیار دلگرمکننده است که CRISPR ایمن و مؤثر است.
گام بعدی، گسترش دامنه داروهای CRISPR است. پزشکی در یک روز ساخته نمیشود. بیماریهای مختلف توسط مکانیسمهای متفاوتی ایجاد میشوند. در حال حاضر بیش از دهها کارآزمایی بالینی CRISPR برای بیماریهای مختلف در کبد، سلولهای ایمنی، چشم و ماهیچهها در حال انجام است. علاوه بر این، ویرایش اپیژنتیک CRISPR در حال گسترش دامنه بیماریها برای درمان انواع بیشتری از دیستروفی عضلانی، اختلالات شبکیه و بیماریهای مغزی است.
۹. علاوه بر درمان بیماریها، سایر کاربردهای واقعی فناوری CRISPR چیست؟
پاسخ کوتاه: برخی دیگر از کاربردها عبارتند از تشخیص، تولید، پایداری و مهندسی اکولوژیکی.
CRISPR میتواند برای تشخیص استفاده شود. این فناوری به عنوان راهی برای تشخیص حساس عوامل بیماریزا در محیط که بدن ما را تحت تأثیر قرار میدهند، توسعه یافته است.
فرصتهایی نیز در تولید وجود دارد، مانند ساخت محصولاتی که برای ما با استفاده از ارگانیسمهایی مانند مخمر و باکتری مهم هستند. تصور کنید که میتوانیم از CRISPR برای مهندسی میکروبهای جدیدی استفاده کنیم که میتوانند تولید را افزایش دهند – مثلاً ۱۰ برابر بیشتر آبجو. و همچنین، آبجویی که طعم بسیار بهتری دارد و میتواند مطابق با خواستهها و نیازهای افراد مختلف باشد.
پایداری نیز یک کاربرد بزرگ برای CRISPR از طریق مهندسی زیستی است. ایجاد روشهای تولید انرژی یا مواد غذایی پایدار و خنثی از نظر کربن یک چالش است. مهندسی ژنوم ممکن است پروتکلهای تولید بهتری را از طریق میکروبهایی ارائه دهد که گازهای گلخانهای، پلاستیک و زبالههای غذایی را کاهش میدهند.
در نهایت، به مهندسی اکولوژیکی میرسیم. برای مثال، مردم در تلاشند تا با استفاده از CRISPR گونههای خاصی از پشههای مهاجم یا بیماریزا را از بین ببرند، اما به نظر من، ایمنی و تأثیر بلندمدت آن هنوز نیاز به ارزیابی دقیق دارد. افراد دیگر در تلاشند تا گونههای منقرض شده را احیا کنند. اخیراً، دانشمندان اعلام کردند که در تلاشند تا ماموت پشمالویی را احیا کنند که میتواند در سرمای قطب شمال زندگی کند. بازگشت به لیست سوالات
۱۰. برخی از نگرانیهای اخلاقی پیرامون CRISPR چیست؟
یک مثال نوزاد طراح (designer baby) است، که موضوعی ترسناک است. این کار غیراخلاقی تلقی میشود زیرا ممکن است یک گونه انسانی جدید ایجاد کند. هنگامی که سلولهای زایا – سلولهای اسپرم و تخمک – ویرایش میشوند، این نه تنها بر آن شخص واحد تأثیر میگذارد، بلکه بر فرزندانی که آن شخص میتواند در آینده داشته باشد نیز تأثیر میگذارد.
نگرانی دیگر در مورد تقسیمبندی درمان است که دارای سه دسته است: درمان (cure)، پیشگیری (prevention) و تقویت (enhancement). درمان بیماری کسی عالی است. پیشگیری، که به معنای در معرض خطر قرار گرفتن فرد برای ابتلا به یک مشکل است، یک منطقه خاکستری است. اگر کسی احتمال زیادی برای ابتلا به یک بیماری عفونی دارد، آیا باید از ژندرمانی برای اصلاح دائمی DNA او برای کاهش خطر استفاده کنیم؟ این سوال واقعاً به این بستگی دارد که آیا گزینههای دیگری داریم یا خیر. آخرین دسته – تقویت – احتمالاً غیراخلاقی است. مردم در مورد امکان هدف قرار دادن ژنی برای رشد بیشتر عضله یا هوشمندتر یا زیباتر کردن افراد صحبت میکنند. اما اگر تحقیقات به این دسته بپردازد، فقط برخی از افراد ممکن است توانایی پرداخت آن را داشته باشند. این میتواند عدم تعادل وضعیت اجتماعی-اقتصادی را تشدید کند. جنبه دیگری که باید در نظر گرفت، ضرورت پزشکی است. آیا این درمان واقعاً ضروری است، یا راههای دیگری برای حل مشکل از طریق داروهای موجود، رژیم غذایی، ورزش و غیره وجود دارد؟
فراتر از پزشکی، برخی از دانشمندان ممکن است بخواهند از CRISPR به دلایل اکولوژیکی استفاده کنند، برای مثال، از بین بردن پشهها. از دیدگاه من، این موضوع بحثبرانگیز است زیرا فکر میکنم هر گونهای به دلیلی وجود دارد. اگر بخواهیم پشهها را از بین ببریم، ممکن است یک واکنش زنجیرهای داشته باشیم که بر سایر اشکال حیات در محیط تأثیر بگذارد و برگشتناپذیر باشد. امیدوارم در آینده بتوانیم این فناوری را برگشتپذیر کنیم، مانند نصب یک سوئیچ، تا اگر چیزی ساختیم که کمتر از حد ایدهآل از آب درآمد، هنوز راهی برای بازنشانی آن داشته باشیم.
۱۱. چگونه میتوانیم CRISPR را وارد سلول کنیم؟
سلولهای انسانی برای مقاومت در برابر هرگونه DNA مهاجم طراحی شدهاند. بنابراین بدن انسان استراتژیهای بسیاری برای جلوگیری از ورود DNA خارجی دارد.
بسیاری از روشهای تحویل که دانشمندان استفاده کردند، قدرت محدودی دارند. میتوانیم از ویروسهای بازسازیشده برای تحویل محصولات بالینی به داخل سلولها استفاده کنیم، اما آنها ظرفیت کمی دارند – نسخه Cas9 از CRISPR معمولاً در داخل ویروس جای نمیگیرد. بنابراین، داروی CRISPR که در حال حاضر تأیید شده است، نیاز به جداسازی سلولهای بیمار، اصلاح آنها و قرار دادن مجدد آنها در بدن دارد. این فرآیند پر هزینه و کند است. اگر میخواهیم CRISPR به یک داروی به طور گسترده مفید تبدیل شود، باید مولکول را تا حد امکان کوچک کنیم.
به همین دلیل CRISPR مینیاتوری ساخته شد که آن را CasMINI مینامند، که تنها نصف اندازه Cas9 است. همچنین ورود آن به سلولها آسانتر است و بهتر از سایر مولکولهای CRISPR کار میکند زیرا میتواند کارآمدتر وارد شود. این CRISPR مینیاتوری میتواند نحوه انجام ویرایش در بدن را متحول کند. امید ما این است که این موانع فنی برطرف شود.
۱۳. آیا CRISPR محدودیتهایی دارد؟
پاسخ کوتاه: محدودیتهایی در ویرایش ژن وجود دارد، اما فناوریهای جدید در تلاشند تا قدرت CRISPR را گسترش دهند.
یک محدودیت اصلی این است که ما تنها ۱۰ سال است که از آن استفاده میکنیم. اغلب، زمان بهترین آزمایش برای همه فناوریها است. تنها با جمعآوری دادهها در طول زمان کافی در همه سناریوها میتوانیم همه چیز را در مورد این فناوریها، مانند میزان ایمنی آنها در بلندمدت، درک کنیم.
در آزمایش بر روی سوژههای انسانی با بیماران، حتی اگر اثرات خارج از هدف یا پاسخهای ایمنی را مشاهده نکردیم، هنوز علامت سوال وجود دارد. ما هنوز باید به طور مداوم درک خود را بهبود بخشیم، و همچنین دقت و صحت CRISPR را در بافتهای مختلف انسانی و بیماران مختلف هنگام درمان یک مشکل افزایش دهیم.
همچنین، در حال حاضر، CRISPR بیشتر به عنوان قیچی مولکولی برای بریدن DNA استفاده میشود. اما گاهی اوقات، اختلال در عملکرد ژن مشکلزا ناشی از جهش DNA نیست. گاهی اوقات، فعال یا غیرفعال شدن غیرطبیعی یک ژن است که مشکل را ایجاد میکند. بنابراین در این حالت، CRISPR نباید به عنوان قیچی مولکولی برای بریدن DNA استفاده شود، بلکه باید به عنوان یک سوئیچ برای بازگرداندن ژن به عملکرد صحیح استفاده شود. ابزارهای ویرایش اپیژنتیک میتوانند به خوبی چنین چالشهایی را برطرف کنند.
CRISPR مانند یک چکش قدرتمند است. اما سوال اینجاست: میخ کجاست؟ مناسبترین میخ برای کار روی آن چیست؟ برای مثال، تا به امروز، ما هنوز به طور قطع نمیدانیم که کدام ژن در بسیاری از بیماران باعث بیماری آلزایمر میشود. برای استفاده از CRISPR، باید بدانیم کدام ژن را هدف قرار دهیم و کدام سلول مقصد است. همچنین باید بدانیم چه زمانی درمان را انجام دهیم – گاهی اوقات درمان تنها میتواند در مراحل اولیه زندگی فرد انجام شود.
مسئله بزرگ دیگر، هزینههای بالای مرتبط با داروهای فعلی CRISPR است. چگونه هزینهها را کاهش دهیم، یک سوال اساسی است.
۱۴. به نظر شما CRISPR در آینده قادر به انجام چه کارهایی است؟
پاسخ کوتاه: این میتواند به بهبود کیفیت زندگی با افزایش سن، مهندسی ارگانیسمهای مفید، و حتی به عنوان یک واکسن جهانی علیه ویروسها کمک کند.
از اینکه CRISPR احتمالاً به ضد پیری کمک میکند، هیجانزدهایم، اما نه به معنای افزایش طول عمر افراد. هیچ کس نمیتواند از پیری فرار کند، و این بار سنگینی بر سیستم مراقبتهای بهداشتی ما است و کیفیت زندگی را کاهش میدهد. امید من این است که در آینده، CRISPR فقط برای نجات جانها استفاده نشود، بلکه برای بهبود کیفیت زندگی افراد در سنین بالا نیز به کار رود.
من همچنین امیدواریم CRISPR بتواند راهی برای مهندسی بسیاری از اشکال حیات مفید شود. به عنوان مثال، میکروبهایی وجود دارند که میتوانند انرژی خورشیدی را جذب کرده و آن را به برق تبدیل کنند، و شاید از آنها بتوان برای تولید انرژی پایدار استفاده کرد. علاوه بر این، میتوانیم مواد غذایی مغذیتر، جلوگیریکننده از چاقی و غیره را مهندسی کنیم.
کاربرد دیگر میتواند واکسنها باشد. حتی در حال حاضر، بیماریهای عفونی، مانند COVID-19، زندگی همه را به طرز چشمگیری تغییر دادهاند، که باورنکردنی است. بنابراین رویای دیگر، توسعه واکسنهای ژنتیکی ارزان و ایمن برای مبارزه با همه ویروسها است، زیرا این نقش اصلی آنها در باکتریها است. و شاید، در آینده، بتوانیم دوز کوچکی از CRISPR را دریافت کنیم که میتواند هر ویروس جدیدی را به طور کامل از بین ببرد. این کار آسانی نیست، اما با توجه به اینکه این سیستم ژنتیکی به عنوان یک سیستم ضد ویروسی طراحی شده است، احتمال کارایی آن وجود دارد.
CRISPR چطور کشف شد؟
CRISPR برای اولین بار در سال ۲۰۱۱ کشف شد، زمانی که «اِمانوئل شارپنتیه» (Emmanuelle Charpentier) در حال مطالعه باکتری Streptococcus pyogenes بود و مولکولی به نام tracrRNA را شناسایی کرد. از طریق تحقیقات او مشخص شد که این RNA بخشی از سیستم ایمنی باستانی باکتریها به نام CRISPR/Cas است که میتواند ویروسها را با بریدن DNA آنها خنثی کند.
شارپنتیه سپس با «جنیفر دودنا» (Jennifer Doudna)، که متخصص RNA بود، همکاری خود را آغاز کرد. این همکاری باعث توسعه سیستمی ساده، دقیق و مؤثر برای ویرایش ژنها شد که امروزه به نام CRISPR شناخته میشود. این فناوری انقلابی در زمینه تحقیقات ژنتیکی و درمانی ایجاد کرد و افقهای جدیدی را در پژوهشهای زیستپزشکی و حتی فراتر از آن گشود.
از دهه ۱۹۷۰، زمانی که دانشمندان فهمیدند جهشهای DNA میتواند باعث بیماری شود، تلاش برای ویرایش ژنها آغاز شد. کشف آنزیمهای برشدهنده DNA (restriction enzymes) به دانشمندان این امکان را داد که برای اولین بار بتوانند DNA را "ببرند و بچسبانند" و DNAهای نوترکیب (ترکیبی از دو منبع متفاوت ژنتیکی) بسازند. این دستاورد، پایهگذار درمانهای ژنی (gene therapy) شد.
اما درمانهای ژنی اولیه کنترل دقیقی بر جایگیری ژنها نداشتند، یعنی ژن جدید ممکن بود در نزدیکی نواحی خاموشکننده یا حتی روی ژنهای سالم قرار بگیرد و مشکلساز شود. دانشمندان به ابزارهایی نیاز داشتند که کنترل بیشتری روی محل و نحوه ویرایش داشته باشند.
تا اوایل دهه ۲۰۰۰، دانشمندان موفق شدند پروتئینهای مصنوعی مانند «زینک فینگر نوکلئاز» (Zinc Finger Nucleases) را طراحی کنند که اجازه میداد بهصورت دقیق یک نقطه خاص از ژنوم هدف قرار گیرد. این روش بسیار دقیقتر و بهتر از روشهای قدیمی با آنزیمهای برشدهنده بود و در واقع، راه را برای پیدایش فناوری CRISPR هموار کرد.
تفاوت CRISPR-Cpf1 با CRISPR-Cas9
CRISPR-Cpf1 از چندین جهت مهم با Cas9 که قبلاً توصیف شده بود، تفاوت دارد که پیامدهای قابل توجهی برای تحقیقات و درمانها دارد.
اولاً، در شکل طبیعی خود، آنزیم برشدهنده DNA به نام Cas9 با دو RNA کوچک ترکیب میشود که هر دو برای فعالیت برشدهی ضروری هستند. اما سیستم Cpf1 سادهتر است زیرا تنها به یک RNA نیاز دارد. آنزیم Cpf1 نیز کوچکتر از SpCas9 استاندارد است، که تحویل آن را به سلولها و بافتها آسانتر میکند.
ثانیاً، و شاید مهمتر از همه، Cpf1 DNA را به روشی متفاوت از Cas9 برش میدهد. هنگامی که کمپلکس Cas9 DNA را برش میدهد، هر دو رشته را در یک مکان برش میدهد و انتهای «کند» باقی میگذارد که اغلب در حین اتصال مجدد دچار جهش میشوند. اما با کمپلکس Cpf1، برشها در دو رشته جابجا شدهاند و انتهای آویزان کوتاهی را در انتهای نمایان شده باقی میگذارند. انتظار میرود این ویژگی به الحاق دقیق کمک کند و به محققان امکان دهد قطعهای از DNA را با کارایی و دقت بیشتری وارد کنند.
ثالثاً، Cpf1 بسیار دور از محل شناسایی برش میدهد، به این معنی که حتی اگر ژن هدف در محل برش جهش یافته باشد، احتمالاً میتوان آن را دوباره برش داد، که فرصتهای متعددی را برای ویرایش صحیح فراهم میکند.
رابعاً، سیستم Cpf1 انعطافپذیری جدیدی را در انتخاب سایتهای هدف فراهم میکند. مانند Cas9، کمپلکس Cpf1 ابتدا باید به یک توالی کوتاه معروف به PAM متصل شود، و اهداف باید در مجاورت توالیهای PAM طبیعی انتخاب شوند. کمپلکس Cpf1 توالیهای PAM بسیار متفاوتی را نسبت به Cas9 شناسایی میکند. این میتواند یک مزیت در هدفگیری، به عنوان مثال، ژنوم انگل مالاریا و حتی ژنوم انسان باشد.
CRISPR: "CRISPR" مخفف عبارت "خوشههای تکرارهای پالیندرومیک کوتاه و با فواصل منظم" است. این نام دشوار، الگویی از توالیهای DNA را توصیف میکند که در ژنوم باکتریها یافت میشود و به باکتریها کمک میکند تا در برابر ویروسها دفاع کنند.
"تکرارهای پالیندرومیک کوتاه" به توالیهایی اشاره دارد که از جلو و عقب یکسان خوانده میشوند، مانند کلمات "کایاک" و "ریسکاری". DNA از دو رشته جفت شده تشکیل شده است که به صورت مارپیچ به دور یکدیگر پیچیدهاند. بنابراین، یک پالیندروم DNA به رشتهای از حروف DNA یا بازها – A (آدنین)، C (سیتوزین)، G (گوانین) و T (تیمین) – اشاره دارد که وقتی در یک رشته از جلو و در رشته دیگر از عقب خوانده میشوند، یکسان هستند.
به عنوان مثال، اگر یک رشته در یک جهت "GATC" خوانده شود، این بازهای DNA با "CTAG" در رشته مقابل جفت میشوند زیرا G همیشه با C و A همیشه با T جفت میشود. وقتی از عقب خوانده شود، CTAG به توالی اصلی، GATC تبدیل میشود.
این تکرارها "به طور منظم با فواصل" هستند، به این معنی که این مناطق CRISPR در ژنوم شامل الگویی متناوب از پالیندرومها با توالیهای "فاصلهگذار" هستند که بین آنها قرار گرفتهاند. باکتریها توالیهای فاصلهگذار را از DNA ویروسهای مهاجم برمیدارند و آنها را در مناطق CRISPR خود ذخیره میکنند تا با عفونتهای آینده مبارزه کنند.
این سیستم اغلب به سیستم ایمنی تطبیقی انسان تشبیه میشود، که به طور مشابه یک "حافظه" از عفونتهای قبلی را برای جلوگیری از مواجهههای تکراری ذخیره میکند. باکتریها به جای استفاده از سلولهای ایمنی، مانند انسان، از CRISPR استفاده میکنند.
CRISPR RNA (crRNA) و Cas9: DNA CRISPR به عنوان سابقه دائمی عفونتهای گذشته عمل میکند، اما برای اینکه باکتریها از این توالیها برای مقابله با ویروسها استفاده کنند، باید آنها را به RNA، خویشاوند DNA، تبدیل کنند. از طریق فرآیندی به نام رونویسی، باکتریها ابتدا یکی از دو رشته DNA CRISPR را به یک رشته مکمل واحد از RNA کپی میکنند؛ این رشته مکمل است به این معنی که با کد DNA اصلی مطابقت دارد، با این تفاوت که T را با U (اوراسیل) جایگزین میکند. سپس، میکروارگانیسمها رشته بلند را به قطعات کوتاهتر crRNA برش میدهند که هر کدام یک تکرار و یک فاصلهگذار را حمل میکنند.
باکتریها همچنین یک مولکول RNA دوم به نام "trans-activating crRNA" یا tracrRNA میسازند. این RNA شامل نسخه معکوس تکرار پالیندرومیک روی مولکول crRNA است، که به دو RNA اجازه میدهد به یکدیگر متصل شوند.
سپس کمپلکس حاصل میتواند به DNA ویروسی حامل توالی فاصلهگذار بچسبد و آنزیمی را فراخوانی کند که آن DNA را برش داده و غیرفعال میکند. این آنزیم، که "پروتئین ۹ مرتبط با CRISPR" یا Cas9 نامیده میشود، اساساً یک جفت قیچی مولکولی است.
انواع دیگری از آنزیمهای Cas نیز وجود دارند که میتوانند در ویرایش ژن استفاده شوند. به عنوان مثال، یکی به نام Cas12a برشهای پلهای در DNA ایجاد میکند، که در آن یک رشته در هر انتها بلندتر از دیگری است. سپس توالیهای DNA میتوانند با رشته آویزان جفت شوند. Cas14 به جای DNA، در RNA برش ایجاد میکند و میتواند برای تغییر موقت پروتئینهایی که یک سلول میسازد بدون ایجاد ویرایشهای دائمی در ژنوم آن مفید باشد.
محققان از قابلیت سیستم CRISPR برای ایجاد برشهای دقیق در DNA بهره بردهاند. با سازگار کردن CRISPR برای ایجاد ویرایشهای ژنومی مطلوب در هر نوع سلولی، محققان میتوانند ژنها یا توالیهای DNA که فعالیت ژنها را تنظیم میکنند، تغییر دهند و عملکرد یا بیان آنها را عوض کنند.
برای سادهسازی سیستم، دانشمندان مولکولهای crRNA و tracrRNA را که در بخش قبلی توضیح داده شد، در یک مولکول واحد به نام "RNA راهنما" ترکیب کردند.

ون ایننام گفت: "تمام کاری که برای هدف قرار دادن یک توالی جدید لازم است، تغییر RNA راهنما است"، که انجام آن ارزان و سریع است. در مقابل، سایر تکنیکهای ویرایش ژنوم نیازمند طراحی زمانبر و پرهزینه یک پروتئین ساختهشده در آزمایشگاه است که یک توالی مورد نظر را هدف قرار میدهد.
RNA راهنما با آنزیم Cas9 جفت میشود تا ویرایشهایی در ژنوم انجام دهد. هنگامی که RNA به توالی مورد نظر متصل میشود، آنزیم وارد عمل شده و هر دو رشته DNA را برش میدهد. در پاسخ، سلول سعی میکند رشتهها را دوباره به هم بچسباند، اما از یک فرآیند پرخطا استفاده میکند که اغلب جهشهایی را ایجاد میکند. به عنوان مثال، ممکن است چند حرف اضافی اضافه کند. این تغییر اغلب ژن را غیرفعال میکند، که ویرایش CRISPR را به یک استراتژی ساده برای خاموش کردن ژنها تبدیل میکند.
دانشمندان همچنین آنزیم Cas9 را برای انجام انواع دیگر ویرایشها اصلاح کردهاند. با غیرفعال کردن قیچیهای ژنتیکی Cas9 و سپس ادغام این "Cas9 مرده" با یک آنزیم دیگر، میتوانند این مکانیسم را دستکاری کنند تا بازهای منفرد را تغییر دهند، به عنوان مثال، یک C را به T تبدیل کنند. این فرمولاسیون CRISPR "ویرایش پایه" نامیده میشود و به محققان امکان میدهد تغییرات ظریفی ایجاد کنند که ساختار محصول کدگذاری شده توسط ژن را تغییر میدهد، خواه پروتئین باشد یا RNA.
Cas9 مرده همچنین با آنزیمهایی که ژنها را فعال یا خاموش میکنند برای تنظیم فعالیت آنها جفت شده است. Cas9 مرده همچنین با پروتئینهای فلورسنت ادغام شده است، که هنگامی که RNA راهنما به یک بخش خاص از DNA متصل میشود، روشن میشوند و اساساً "کد پستی" آن را در سلول نشان میدهند.
تاریخچه CRISPR به سال 1987 باز میگردد، زمانی که یوشیزومی ایشینو و همکارانش در دانشگاه اوزاکا در ژاپن برای اولین بار توالیهای غیرمعمول تکراری را در اشریشیا کلی، یک باکتری شناختهشده، گزارش کردند. در آن زمان، دانشمندان نمیدانستند که این خوشهها چگونه با دفاع باکتریایی مرتبط هستند.
در دهه 1990، این خوشهها توجه دانشمندان بیشتری را به خود جلب کردند، زمانی که فرانسیسکو موژیکا (که اصطلاح "CRISPR" را ابداع کرد) و تیمش در دانشگاه آلیکانته اسپانیا، آنها را در 20 ژنوم باکتریایی دیگر مشاهده کردند، که نشان میداد آنها اهمیت گستردهای در باکتریها دارند.
در سال 2005، الکساندر بولوتین و همکارانش در موسسه ملی تحقیقات کشاورزی فرانسه، ژنهایی برای آنزیمهای Cas را در نزدیکی منطقه CRISPR یک ژنوم کشف کردند. اندکی پس از آن، گروه یوجین کونین در موسسه ملی بهداشت فاش کرد که توالیهای فاصلهگذار با DNA ویروسی مطابقت دارند، که منجر به ارتباط CRISPR با ایمنی باکتریایی شد.
امانوئل شارپنتیه، از موسسه ماکس پلانک در آلمان، و جنیفر دودنا، از دانشگاه کالیفرنیا، برکلی، بعدها CRISPR را برای ویرایش ژنوم سازگار کردند. کار آنها منجر به اشتراکگذاری جایزه نوبل شیمی 2020 شد.
اندکی پس از انتشار مقاله پیشگامانه شارپنتیه و دودنا، ویرجینیوس سیکشنیس از موسسه بیوتکنولوژی دانشگاه ویلنیوس و همکارانش نیز نشان دادند که چگونه CRISPR میتواند در ویرایش ژن استفاده شود. گروه فنگ ژانگ در موسسه برود بعدها سیستمهای CRISPR دیگری را به ابزارهای ویرایش ژن توسعه دادند، از جمله یک سیستم ویرایش RNA شامل آنزیمی به نام Cas13.
CRISPR برای اصلاح اختلالات ژنتیکی، مانند فیبروز کیستیک و آب مروارید، در سلولهای کشت شده در آزمایشگاه و حیوانات آزمایشگاهی استفاده شده است. همچنین موفقیتهای اخیر را به عنوان درمانی برای سایر شرایط در آزمایشات انسانی نشان داده است. قابل ذکر است، بریتانیا و ایالات متحده هر دو یک ژندرمانی مبتنی بر CRISPR به نام Casgevy را برای دو اختلال خونی تأیید کردهاند: بیماری سلول داسیشکل و بتا تالاسمی. این اولین درمان مبتنی بر CRISPR است که تاکنون تأیید شده است.
Casgevy با برش و غیرفعال کردن ژن BCL11A کار میکند، که سوئیچ از هموگلوبین جنینی به هموگلوبین بزرگسال را اندکی پس از تولد کنترل میکند.
نسخه جنینی اکسیژن را قویتر متصل میکند، که به جنین اجازه میدهد اکسیژن کافی را از جریان خون مادرش دریافت کند. نسخه بزرگسال به طور معمول پس از تولد، زمانی که اکسیژن از طریق تنفس به دست میآید، کنترل را به دست میگیرد. با این حال، در بیماری سلول داسیشکل و بتا تالاسمی، افراد نسخههای معیوبی از ژن بزرگسال را دارند. Casgevy سوئیچ به هموگلوبین بزرگسال را معکوس میکند تا بیماران بتوانند به جای آن از ژن هموگلوبین جنینی خود استفاده کنند.
یکی از اشکال نابینایی ارثی ممکن است از جمله اختلالات بعدی باشد که با استفاده از CRISPR درمان میشود. یک آزمایش اولیه تزریق اجزای CRISPR به چشم را آزمایش کرد و نشان داد که این روش ایمن و موثر است. شکل ویرایش پایه CRISPR نیز نتایج امیدوارکنندهای را در کاهش سطح کلسترول در یک آزمایش کوچک نشان داد.
فراتر از مراقبتهای بهداشتی، ویرایش CRISPR برای بهبود حداقل 41 محصول غذایی، از جمله برنج و گندم، با بهبود قابلیت چشایی، ارزش غذایی و مقاومت آنها در برابر بیماریها استفاده شده است. همچنین برای ویرایش ژنهای خوکهایی استفاده شده است که اندامهای آنها سپس برای عملهای پیوند انسان برداشت میشوند.
علاوه بر این، ون ایننام از CRISPR در آزمایشات اثبات مفهوم برای اعطای ویژگیهای مطلوب به حیوانات پرورشی استفاده میکند. به عنوان مثال، او بازده گوشت در گاو را افزایش میدهد تا کشاورزان بتوانند دام کمتری پرورش دهند و در نتیجه تأثیر زیستمحیطی خود را محدود کنند.

این احتمال وجود دارد که ویرایشهای ناخواسته (off-target edits) بتوانند سلامت حیوانات را مختل کنند. اما ون ایننام استدلال میکند که این نگرانیها اغلب مبالغهآمیز هستند. او توضیح داد: "به معنای واقعی کلمه میلیونها تغییر ژنتیکی بین دو گاو نر ناشی از جهشهای طبیعی وجود خواهد داشت، بنابراین اثرات ناخواسته فقط قطرهای در اقیانوس هستند."
با این حال، سازمان غذا و داروی ایالات متحده (FDA) میگوید که ویرایش ژنوم حیوانات پرورشی نیازمند نظارت فراوان است، بخشی به این دلیل که توالیهای DNA دیگر اغلب ژن جدیدی را که به ژنوم وارد میشود، همراهی میکنند. FDA میگوید این حاملها (carryovers) باید به دقت بررسی شوند تا اطمینان حاصل شود که برای حیوان یا مصرفکنندگان انسانی خطرناک نیستند. ون ایننام خاطرنشان کرد که اگر سازمان یک حیوان ویرایش شده را با خطر پایین ارزیابی کند، میتواند "اختیار اجرایی" اعطا کند که به آن و فرزندانش اجازه تجاریسازی میدهد.
این نوع ویرایش ژرملاین (germ-line editing) به ندرت در انسانها به کار رفته است، به جز در مورد بحثبرانگیز یک دانشمند چینی که به طور بدنام "نوزادان CRISPR" را در نقض مقررات تولید کرد. یکی از دلایل بزرگ اجتناب از ویرایش ژرملاین انسانی این است که نسلهای آینده نمیتوانند رضایت خود را برای دریافت درمان CRISPR اعلام کنند.
نسلهای آینده همچنین نمیتوانند با احتمال اثرات ناخواسته مضر، مانند جهشهایی که میتوانند فرد را مستعد ابتلا به سرطان کنند، موافقت کنند. نیتا فاراهانی، متخصص اخلاق زیستی در دانشگاه دوک، به نیویورک تایمز گفت که ویرایش جنینها غیراخلاقی خواهد بود "تا زمانی که بتوانیم بفهمیم اثرات ناخواسته چیست و چگونه میتوانیم آنها را کنترل کنیم."
آکادمیهای ملی علوم، مهندسی و پزشکی معیارهایی را برای پیشبرد آزمایشات بالینی ویرایش ژرملاین تعیین کردهاند. این گروه توصیه میکند که ویرایش ژرملاین انسانی به ژنهایی محدود شود که جهشهای آنها میتوانند منجر به بیماریهای جدی شوند و هیچ درمان دیگری برای آنها وجود ندارد.
در حال حاضر، ژندرمانیها عمدتاً از تکنیکی به نام "ویرایش سوماتیک" (somatic editing) استفاده میکنند. به عنوان مثال، Casgevy به این دسته تعلق دارد. ویرایش سوماتیک با هدف قرار دادن زیرمجموعهای از سلولهای غیرجنسی در بدن کار میکند و بنابراین هیچ تغییری را به نسلهای بعدی منتقل نمیکند.
ون ایننام گفت: "فایده آن به وضوح بر هرگونه ریسک فرضی پیشی میگیرد" در این زمینهها، بنابراین ویرایش سوماتیک CRISPR در مورد ژندرمانی "یک امر بدیهی" است.
منابع:
1-https://www.livescience.com/58790-crispr-explained.html
2-https://www.gao.gov/products/gao-20-478sp
3-https://www.cbinsights.com/research/what-is-crispr/
4-