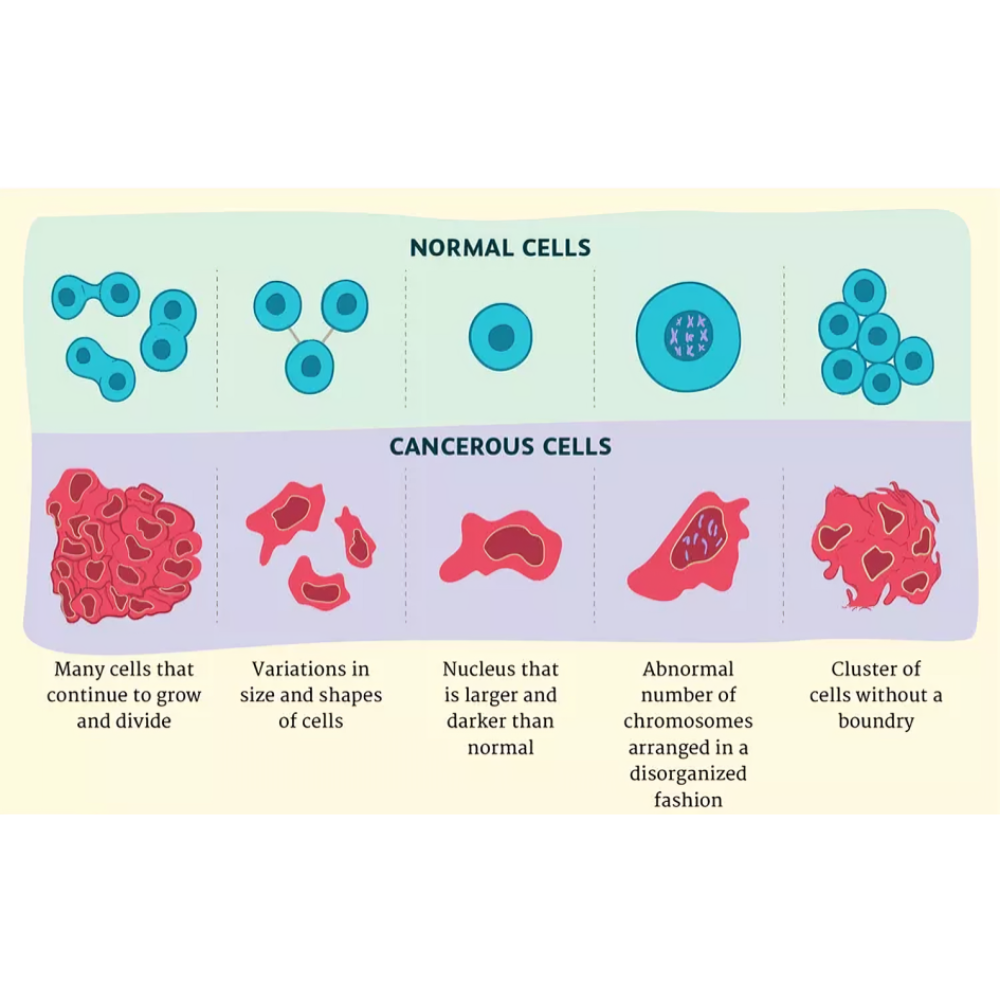
مقایسه ساختار سلولی در سرطان و سلول طبیعی
مقدمه
سرطان به عنوان یکی از بزرگترین چالشهای پزشکی و سلامت در جهان، هر ساله میلیونها نفر را تحت تأثیر قرار میدهد. این بیماری زمانی شکل میگیرد که سلولهای طبیعی بدن دچار تغییرات ساختاری و عملکردی میشوند و به طور غیرقابل کنترل شروع به تکثیر و گسترش میکنند. تفاوتهای بنیادین بین سلولهای طبیعی و سلولهای سرطانی نه تنها در عملکرد، بلکه در ساختار سلولی نیز دیده میشود که نقش کلیدی در بقا، مهاجرت، و پاسخ به درمانهای مختلف ایفا میکند.
درک دقیق این تفاوتهای ساختاری، از سطح غشاء سلولی تا هسته و اجزای داخلی، میتواند افقهای جدیدی را در درمان سرطان بگشاید و به توسعه روشهای هدفمند و مؤثر کمک کند. تغییرات ساختاری سلولهای سرطانی باعث میشود که این سلولها انعطافپذیری بیشتری داشته باشند، بتوانند از موانع طبیعی بدن عبور کنند و در برابر داروها مقاومت نشان دهند.
علاوه بر این، سلولهای سرطانی در یک میکرومحیط پیچیده و پویا قرار دارند که خود بر ساختار و رفتار آنها تأثیر میگذارد. این تعاملات پیچیده میان سلولهای سرطانی و محیط اطرافشان، چالشهای متعددی در درمان سرطان ایجاد میکند.
هدف این مقاله، ارائه یک مرور جامع بر تفاوتهای ساختاری بین سلولهای طبیعی و سلولهای سرطانی است. در این مسیر، علاوه بر بررسی ویژگیهای اساسی سلولهای طبیعی، تغییرات مهمی که سلولهای سرطانی در ساختار خود تجربه میکنند و تأثیرات میکرومحیط تومور بر این تغییرات را مورد بررسی قرار خواهیم داد. همچنین، مکانیزمهای مولکولی و پیامدهای این تغییرات ساختاری بر رفتار تهاجمی و مقاومت درمانی سلولهای سرطانی، و در نهایت رویکردهای نوین در درمان بر اساس شناخت دقیق این ساختارها، در این مقاله مطرح میشوند.
با مطالعه این مقاله، متخصصان و علاقهمندان به حوزه سرطان میتوانند دانش عمیقتر و جامعتری نسبت به تحول سلولی در سرطان به دست آورده و از این اطلاعات در تحقیقات و درمانهای بالینی بهرهمند شوند.
شناخت اولیه سلولهای طبیعی
سلولهای طبیعی، واحدهای بنیادین حیات در همه موجودات زنده هستند و وظایف بسیار مهمی را در حفظ سلامت و کارکرد صحیح بدن بر عهده دارند. این سلولها دارای ساختاری منظم و متعادل هستند که عملکردهای حیاتی مانند تولید انرژی، تکثیر، و ارتباط با محیط پیرامون را به طور هماهنگ انجام میدهند.
ویژگیهای اصلی ساختار سلولی طبیعی
ساختار سلول طبیعی به گونهای طراحی شده است که ضمن حفظ پایداری، امکان پاسخ سریع به تغییرات محیطی را فراهم کند. هر سلول شامل چند بخش اصلی است که هر کدام وظیفه خاصی دارند:
-
غشاء سلولی: این لایه نیمهنفوذپذیر از فسفولیپیدها و پروتئینها تشکیل شده است و سلول را از محیط اطراف جدا میکند. غشاء سلولی وظیفه کنترل ورود و خروج مواد را بر عهده دارد و نقش مهمی در حفظ تعادل یونی و سیگنالدهی سلولی دارد. همچنین، ساختار منظم و نسبت متعادل چربیها و پروتئینهای غشاء باعث حفظ شکل و استحکام سلول میشود.
-
هسته سلولی: هسته به عنوان مرکز کنترل سلول شناخته میشود و محل ذخیره DNA است. DNA حامل اطلاعات ژنتیکی است که فعالیتهای سلول را تنظیم میکند. در سلولهای طبیعی، هسته ساختاری منظم دارد و کروماتین به صورت سازمانیافته در آن قرار گرفته است تا امکان رونویسی دقیق ژنها فراهم شود.
-
سیتوپلاسم و اندامکها : فضای داخلی سلول مملو از مایع ژل مانند به نام سیتوزول است که اندامکهایی مانند میتوکندری، شبکه آندوپلاسمی، دستگاه گلژی، و لیزوزومها را در خود جای داده است. هر اندامک وظیفه مشخصی دارد؛ برای مثال، میتوکندری مرکز تولید انرژی سلول است و شبکه آندوپلاسمی مسئول سنتز پروتئینها و لیپیدهاست.
-
اسکلت سلولی (سیتوسکللتون) : ساختار سهبعدی که از رشتههای پروتئینی تشکیل شده و به حفظ شکل سلول کمک میکند. این اسکلت سلولی علاوه بر حفظ شکل، در جابهجایی اندامکها، تقسیم سلولی، و ارتباطات بین سلولی نقش دارد.
تنظیم چرخه سلولی و آپوپتوز
سلولهای طبیعی دارای مکانیسمهای پیچیدهای برای کنترل چرخه سلولی هستند که تضمین میکند تقسیم سلولی تنها در شرایط مناسب و به صورت کنترل شده رخ دهد. این چرخه شامل مراحل مختلفی است که منجر به تکثیر دقیق DNA و تقسیم سلول میشود.
همچنین، سلولهای طبیعی به طور خودکار قابلیت آپوپتوز یا مرگ برنامهریزیشده سلولی را دارند. این فرآیند مهم برای حذف سلولهای آسیبدیده یا غیر ضروری است و از رشد سلولهای غیرطبیعی جلوگیری میکند.
نقش محیط سلولی و ماتریکس خارجسلولی
سلولهای طبیعی در یک محیط پیچیده به نام میکرو محیط سلولی قرار دارند که شامل ماتریکس خارجسلولی (ECM)، سلولهای همسایه، و مولکولهای سیگنالدهنده است. این ماتریکس از پروتئینها و کربوهیدراتها تشکیل شده و نقش ساختاری و سیگنالینگ برای سلولها دارد.
ماتریکس خارجسلولی علاوه بر حمایت مکانیکی، در تنظیم رفتار سلولی، مهاجرت، و تمایز نقش دارد. ارتباط دوطرفه بین سلول و ECM به حفظ هومئوستازی بافتها کمک میکند و در کنترل رشد سلولی مؤثر است.
در این بخش، پایههای ساختاری و عملکردی سلولهای طبیعی بررسی شد تا بتوانیم در ادامه، تغییرات مهمی که در سلولهای سرطانی رخ میدهد را بهتر درک کنیم.
تغییرات ساختاری در سلولهای سرطانی
سلولهای سرطانی در مقایسه با سلولهای طبیعی، دچار تغییرات بنیادینی در ساختار و عملکرد خود میشوند که زمینهساز رشد غیرقابل کنترل، مهاجرت و مقاومت به درمان میگردد. این تغییرات نه تنها در سطح مولکولی، بلکه در ساختارهای کلان سلولی و تعاملات آنها با محیط پیرامونشان نیز نمود پیدا میکند.
تغییرات در غشاء سلولی و دینامیک آن
یکی از بارزترین تفاوتهای ساختاری سلولهای سرطانی، اختلال در ترکیب و ساختار غشاء سلولی است. در سلولهای سرطانی نسبت چربیها و پروتئینهای غشاء به طور چشمگیری تغییر میکند. به ویژه، افزایش میزان لیپیدهای اشباع و تغییر در توزیع فسفولیپیدها باعث افزایش انعطافپذیری غشاء میشود. این ویژگی به سلولهای سرطانی امکان میدهد به راحتی شکل خود را تغییر داده، از موانع بافتی عبور کنند و مهاجرت کنند.
علاوه بر این، کانالها و گیرندههای غشاء در سلولهای سرطانی به صورت غیرطبیعی فعال یا غیرفعال میشوند. این تغییرات، مسیرهای سیگنالدهی مرتبط با رشد، بقا و متاستاز را به شکل نامناسبی تحریک میکند.
بینظمی در ساختار هسته و کروماتین
هسته سلولهای سرطانی اغلب بزرگتر و نامنظمتر از سلولهای طبیعی است. کروماتین در این سلولها به شکل پراکندهتر و کمتر سازمانیافته دیده میشود که موجب بروز اختلال در رونویسی ژنها و بیثباتی ژنتیکی میشود. این بیثباتی زمینه را برای جهشهای بیشتر و تنوع سلولی فراهم میکند که از مشخصههای بارز سرطان است.
در بسیاری از سلولهای سرطانی، مقدار و ساختار نوکلئولوس نیز تغییر میکند. این بخش که مسئول سنتز ریبوزوم است، در سلولهای سرطانی بزرگتر بوده و فعالیت آن افزایش یافته است تا نیاز سلول به تولید پروتئینهای اضافی برای رشد سریع را تأمین کند.
اختلال در اسکلت سلولی و تغییر شکل سلول
یکی دیگر از تغییرات کلیدی، دگرگونی در اسکلت سلولی است. رشتههای اکتین، میکروتوبولها و اینترمدیتها در سلولهای سرطانی بازآرایی میشوند تا به سلول قابلیت حرکت بیشتر و انعطافپذیری بدهند. این بازآراییها منجر به تغییر شکل سلول، افزایش قدرت چسبندگی به محیط و تسهیل مهاجرت سلولهای سرطانی میشود.
تحقیقات با استفاده از فناوریهایی مانند نیروسنجی میکرومکانیکی (AFM) نشان دادهاند که سلولهای سرطانی به طور قابل توجهی نرمتر و انعطافپذیرتر از سلولهای طبیعی هستند. این خاصیت نرم بودن کمک میکند تا سلولهای سرطانی راحتتر از دیوارههای عروق عبور کنند و به محلهای دوردست در بدن مهاجرت نمایند.
اختلال در مکانیسمهای تنظیم چرخه سلولی و مرگ برنامهریزیشده
سلولهای سرطانی معمولاً از مکانیسمهای طبیعی کنترل چرخه سلولی و آپوپتوز فرار میکنند. این فرار به دلیل تغییرات ساختاری و عملکردی در پروتئینهای کلیدی مانند p53 ، Rb و سایر فاکتورهای تنظیمکننده رخ میدهد. این اختلالات به سلول اجازه میدهد که بدون کنترل تکثیر یافته و از مرگ برنامهریزیشده جلوگیری کند.
بازآرایی ماتریکس خارجسلولی و تاثیر بر رفتار سلولهای سرطانی
میکرو محیط تومور، شامل ماتریکس خارجسلولی، به شدت تحت تأثیر سلولهای سرطانی و تغییرات آنها قرار میگیرد. سلولهای سرطانی باعث بازسازی و تغییر ترکیب ماتریکس میشوند که به افزایش سفتی و تغییر در ساختار سهبعدی محیط منجر میشود. این بازآراییها نه تنها مهاجرت و تهاجم سلولهای سرطانی را تسهیل میکند، بلکه مقاومت آنها به داروهای شیمیدرمانی را نیز افزایش میدهد.
تجمع وزیکولها و اگزوزومها به عنوان ابزار ارتباطی
سلولهای سرطانی با افزایش تولید وزیکولهای کوچک به نام اگزوزوم، پیامهای مولکولی خود را به سلولهای مجاور و حتی دور دست ارسال میکنند. این وزیکولها حامل پروتئینها، RNA های کوچک و دیگر مولکولها هستند که به تغییر رفتار سلولهای سالم اطراف کمک میکنند و محیط تومور را به نفع رشد و گسترش سرطان تنظیم میکنند.
این تغییرات ساختاری پیچیده و چندسطحی، اساس توانایی سلولهای سرطانی برای بقا، رشد و متاستاز را تشکیل میدهند. در بخشهای بعدی، به بررسی مولکولیتر این تغییرات و تأثیر آنها بر رفتار تهاجمی سرطان خواهیم پرداخت.
تغییرات میکرومحیط تومور و تاثیر آن بر ساختار سلولی
میکرومحیط تومور، شامل مجموعهای پیچیده از سلولها، ماتریکس خارجسلولی، عروق خونی، و مولکولهای سیگنالدهنده است که به طور پویا با سلولهای سرطانی در تعامل است. این محیط نه تنها پشتیبان رشد و بقاء سلولهای سرطانی است، بلکه تأثیر عمیقی بر تغییرات ساختاری و رفتاری سلولهای سرطانی دارد.
تنوع و پیچیدگی سلولی در میکرومحیط تومور
در میکرومحیط تومور، انواع مختلفی از سلولها وجود دارند که هر کدام نقش منحصر به فردی در تنظیم ساختار و عملکرد سلولهای سرطانی ایفا میکنند. از جمله این سلولها میتوان به سلولهای ایمنی (ماکروفاژهای وابسته به تومور، لنفوسیتها)، سلولهای استرومایی )فیبروبلاستها)، و سلولهای اندوتلیال اشاره کرد.
ماکروفاژهای وابسته به تومور (TAMs) به واسطه ترشح لاکتیک اسید و سیتوکینهای خاص، موجب قطبش عملکردی و تغییر وضعیت ایمنی میکرومحیط میشوند. این تغییر وضعیت باعث تقویت بقاء و مهاجرت سلولهای سرطانی شده و در نهایت منجر به تغییرات ساختاری پایدار در سلولها میگردد.
تاثیر سفتی ماتریکس خارجسلولی بر رفتار سلولهای سرطانی
ماتریکس خارجسلولی (ECM) در میکرومحیط تومور دستخوش بازسازیهای گستردهای میشود که منجر به افزایش سفتی بافتی میگردد. این سفتی بر اساس تغییرات در پروتئینهای ساختاری مانند کلاژن و فیبرونکتین افزایش مییابد و به تغییرات مکانیکی در سلولهای سرطانی منجر میشود.
افزایش سفتی ماتریکس باعث فعال شدن مسیرهای سیگنالدهی مکانوترانسداکشن میشود که ساختار اسکلت سلولی را تحت تأثیر قرار داده و سلول را برای مهاجرت و تهاجم آماده میکند. همچنین، این تغییرات میتوانند پاسخ سلولهای سرطانی به درمانهای شیمیدرمانی را کاهش دهند.
تبادلات مولکولی بین سلولهای سرطانی و استرومال
سلولهای استرومایی مانند فیبروبلاستهای مرتبط با تومور (CAFs) نقش مهمی در تغییر ساختار و عملکرد سلولهای سرطانی دارند. این سلولها از طریق ترشح فاکتورهای رشد، پروتئازها و میکروRNAهای اگزوزومی، ماتریکس خارجسلولی را بازسازی کرده و موجب افزایش مهاجرت و رشد سلولهای سرطانی میشوند.
به علاوه، CAFها با بازآرایی ساختار اسکلت سلولی و افزایش انعطافپذیری سلولهای سرطانی، کمک میکنند تا این سلولها از سدهای بافتی عبور کنند و به بافتهای دوردست متاستاز دهند.
تأثیر نواحی کماکسی در میکرومحیط تومور
در بسیاری از تومورها، به دلیل رشد سریع و نارسایی در شبکه عروقی، نواحی با کمبود اکسیژن (هیپوکسی) ایجاد میشود. این شرایط باعث فعال شدن مسیرهای تنظیمکننده مانند HIF-1α میگردد که منجر به تغییرات ژنتیکی و اپیژنتیکی در سلولهای سرطانی میشود.
هیپوکسی همچنین موجب بازآرایی اسکلت سلولی و تغییر بیان پروتئینهای اتصالدهنده سلولی میگردد و بدین ترتیب مهاجرت سلولهای سرطانی و تهاجم آنها به بافتهای مجاور را تسهیل میکند.
تعامل با عروق خونی و نقش آن در تغییر ساختار سلولهای سرطانی
رشد رگهای خونی جدید (آنژیوژنز) در میکرومحیط تومور، علاوه بر تأمین مواد مغذی، به تغییرات ساختاری سلولهای سرطانی نیز کمک میکند. فاکتورهای ترشح شده توسط سلولهای سرطانی و سلولهای استرومایی موجب بازسازی اسکلت سلولی و افزایش انعطافپذیری این سلولها میشوند.
این تغییرات باعث میشوند سلولهای سرطانی بهتر بتوانند وارد گردش خون شده و به نقاط دوردست مهاجرت کنند. به علاوه، سلولهای سرطانی با استفاده از وزیکولهای اگزوزومی، پیامهای مولکولی خود را به سلولهای اندوتلیال ارسال میکنند تا مسیر آنژیوژنز و تغییرات ساختاری مرتبط را تنظیم نمایند.
میکروRNAها و وزیکولهای خارج سلولی در تغییرات ساختاری
وزیکولهای خارج سلولی (EVs) و به ویژه اگزوزومها، حاملهای مهم پیامهای مولکولی بین سلولهای تومور و محیط اطراف هستند. انتقال میکرو RNAها و پروتئینهای خاص از طریق این وزیکولها باعث تغییر در بیان ژنها و مسیرهای سیگنالینگ سلولهای گیرنده میشود.
این فرآیند منجر به تغییرات ساختاری در سلولهای مجاور و حتی سلولهای سرطانی میشود که شامل بازآرایی اسکلت سلولی، تغییر انعطافپذیری و افزایش قابلیت مهاجرت میگردد.
میکرومحیط تومور، یک سیستم پویا و پیچیده است که تغییرات آن نقش کلیدی در بازسازی ساختار سلولهای سرطانی ایفا میکند. این تغییرات ساختاری نه تنها به بقای سلولهای سرطانی کمک میکنند، بلکه توانایی آنها در مهاجرت، تهاجم و مقاومت به درمان را افزایش میدهند. درک دقیق این فرآیندها میتواند راهکارهای نوینی برای مقابله با سرطان و بهبود درمانها ارائه دهد.
مکانیزمهای مولکولی و ژنتیکی تغییرات ساختاری
تغییرات ساختاری در سلولهای سرطانی، نتیجه مستقیم تحولات پیچیده در سطح مولکولی و ژنتیکی هستند که موجب بازبرنامهریزی رفتار و شکل سلول میشوند. این مکانیزمها شامل تغییرات در بیان ژنها، تنظیم مسیرهای سیگنالینگ، و اصلاحات اپیژنتیکی است که به طور هماهنگ ساختار اسکلت سلولی، اتصالات بینسلولی و دینامیک غشا را دگرگون میکنند.
تغییرات در بیان ژنهای مرتبط با اسکلت سلولی
یکی از مهمترین عوامل در تغییر ساختار سلولی، تغییر در بیان ژنهایی است که مسئول تنظیم اسکلت سلولی هستند. ژنهای کدکننده اکتین، میوزین، توبولین و پروتئینهای مرتبط مانند فیلامین و اسپکتین تحت تأثیر مستقیم جهشها یا تنظیم نادرست قرار میگیرند. این تغییرات منجر به بازآرایی ساختاری و دینامیکی اسکلت سلولی میشود که قابلیت مهاجرت و تهاجم سلولهای سرطانی را افزایش میدهد.
نقش مسیرهای سیگنالینگ در تنظیم ساختار سلولی
مسیرهای سیگنالینگ کلیدی مانند Rho GTPases، PI3K/AKT و MAPK/ERK در تغییر رفتار سلولهای سرطانی و بازآرایی اسکلت سلولی نقش مهمی دارند. فعالسازی بیش از حد این مسیرها موجب افزایش تحرک سلول، تغییر شکل و گسترش سلولهای توموری میشود.
برای مثال، مسیر Rho GTPases تنظیم کننده مستقیم سازماندهی اسکلت اکتینی است و از طریق کنترل تشکیل استرس فیبرها و لاملویپودها، تغییرات ساختاری در سلول را هدایت میکند.
تأثیر جهشهای ژنتیکی بر ساختار سلولی
جهشهای کلیدی در ژنهایی مانند TP53، KRAS، و PTEN میتوانند منجر به اختلال در کنترل چرخه سلولی و مسیرهای سیگنالینگ شوند. این اختلالات سبب تغییرات پایدار در ساختار سلول و افزایش توانایی مهاجرت و متاستاز میگردد.
به عنوان مثال، جهش در ژن TP53 که به عنوان "نگهبان ژنوم" شناخته میشود، علاوه بر از دست رفتن کنترل رشد، موجب اختلال در اتصالهای سلولی و بازآرایی اسکلت سلولی میشود.
تنظیمات اپیژنتیکی و نقش آن در تغییرات ساختاری
علاوه بر تغییرات ژنتیکی، تغییرات اپیژنتیکی مانند متیلاسیون DNA و تغییرات در هیستونها نیز در تنظیم بیان ژنهای مرتبط با ساختار سلولی نقش دارند. این تغییرات میتوانند به صورت برگشتپذیر یا پایدار، ساختار و عملکرد سلولهای سرطانی را تحت تأثیر قرار دهند.
متیلاسیون غیرطبیعی در مناطق تنظیمکننده ژنهای کنترلکننده اسکلت سلولی میتواند منجر به کاهش یا افزایش بیان پروتئینهای کلیدی شده و تغییراتی را در شکل و رفتار سلولی ایجاد کند.
تبادل سیگنال بین هسته و اسکلت سلولی
ارتباط دوطرفه بین هسته سلول و اسکلت سلولی، نقش مهمی در انتقال سیگنالهای مکانیکی و بیوشیمیایی دارد. تغییرات در این ارتباط باعث میشود سلولهای سرطانی بتوانند پاسخهای سریع و موثری به شرایط محیطی و فشارهای مکانیکی داشته باشند.
این تعاملات به ویژه از طریق پروتئینهایی مانند لَمینها و اینتراممبری هسته، و مولکولهای مرتبط با اسکلت اکتینی و میوزین انجام میشود که در تغییر شکل و حرکت سلولی دخیلاند.
نقش میکروRNAها در تنظیم ساختار سلول سرطانی
میکروRNAها (miRNA) که نقش تنظیمکننده بیان ژن را دارند، در تنظیم مسیرهای سیگنالینگ و ژنهای اسکلت سلولی نیز مؤثر هستند. تغییرات در الگوهای بیان میکرو RNA میتواند موجب سرکوب ژنهای مهارکننده مهاجرت و افزایش بیان ژنهای تسهیلکننده تغییرات ساختاری شود.
به عنوان نمونه، افزایش بیان miR-21 با سرکوب ژنهای مهارکننده تومور باعث تقویت فرآیندهای مهاجرت و بازآرایی اسکلت سلولی در سلولهای سرطانی میشود.
مکانیزمهای مولکولی و ژنتیکی تغییرات ساختاری در سلولهای سرطانی، ترکیبی از تغییرات ژنی، تنظیم مسیرهای سیگنالینگ، و اصلاحات اپیژنتیکی هستند که منجر به بازآرایی پیچیده اسکلت سلولی و تغییر در ارتباطات سلولی میشوند. فهم دقیق این مکانیزمها میتواند به شناسایی هدفهای درمانی جدید و بهبود استراتژیهای مقابله با سرطان کمک کند.
پیامدهای تغییرات ساختاری بر رفتار و درمان سرطان
تغییرات ساختاری در سلولهای سرطانی تنها به دگرگونیهای ظاهری محدود نمیشود، بلکه تأثیرات عمیقی بر رفتار سلول و پاسخ آن به درمانهای مختلف دارد. این تغییرات به طور مستقیم یا غیرمستقیم روند پیشرفت بیماری و اثربخشی درمانها را شکل میدهند.
تأثیر تغییرات ساختاری بر مهاجرت و متاستاز
یکی از پیامدهای مهم تغییرات ساختاری، افزایش قابلیت مهاجرت و متاستاز سلولهای سرطانی است. بازآرایی اسکلت سلولی و کاهش اتصالات بینسلولی موجب میشود که سلولها بتوانند به آسانی از محل اولیه جدا شده و به بافتها و اندامهای دیگر بدن نفوذ کنند.
این تغییرات ساختاری، همراه با افزایش انعطافپذیری سلولها، توانایی آنها را برای عبور از موانع فیزیکی و دیوارههای رگهای خونی و لنفاوی افزایش میدهد و روند گسترش سرطان را تسریع میکند.
مقاومت سلولهای سرطانی به درمانها
تغییرات در ساختار سلولی همچنین میتواند موجب مقاومت دارویی شود. تغییرات در غشای سلولی، کاهش نفوذپذیری داروها، و تغییر در مسیرهای سیگنالینگ مرتبط با آپوپتوز، از جمله مکانیزمهایی هستند که سلولهای سرطانی را نسبت به داروهای شیمیدرمانی مقاوم میسازند.
علاوه بر این، بازآرایی اسکلت سلولی و تغییرات میکرومحیطی، توانایی سلولهای سرطانی را برای بقاء در شرایط استرسزا افزایش میدهد و این امر چالش بزرگی در موفقیت درمانها ایجاد میکند.
تغییرات ساختاری و فرار از سیستم ایمنی
ساختار دگرگون شده سلولهای سرطانی، نقش مهمی در فرار آنها از شناسایی و تخریب توسط سیستم ایمنی دارد. این تغییرات میتوانند از طریق کاهش بیان مولکولهای شناساگر سطحی یا تغییر در شکل و اندازه سلول، باعث کاهش کارایی سلولهای ایمنی شوند.
پیامدهای تغییرات ساختاری بر تشخیص و تصویربرداری
تغییرات در ساختار سلولی و بافتی میتواند بر نتایج روشهای تشخیصی و تصویربرداری تأثیر بگذارد. به عنوان مثال، تغییرات در نفوذپذیری و چگالی سلولی ممکن است سیگنالهای تصویربرداری را تغییر دهند و چالشهایی در تشخیص زودهنگام ایجاد کنند.
راهکارهای نوین درمان مبتنی بر درک تغییرات ساختاری
با شناخت دقیقتر از تغییرات ساختاری سلولهای سرطانی، درمانهای هدفمند جدیدی توسعه یافتهاند که به بازگرداندن یا مهار این تغییرات میپردازند. استفاده از داروهایی که مسیرهای سیگنالینگ مرتبط با بازآرایی اسکلت سلولی را هدف قرار میدهند، نمونهای از این رویکردهاست.
علاوه بر آن، درمانهای ترکیبی که همزمان مهاجرت سلولی و مقاومت دارویی را هدف میگیرند، در مطالعات بالینی نتایج امیدوارکنندهای نشان دادهاند.
تغییرات ساختاری در سلولهای سرطانی تأثیرات گستردهای بر رفتار سلول، توانایی مهاجرت، مقاومت به درمان و تعامل با سیستم ایمنی دارند. فهم این پیامدها برای طراحی درمانهای مؤثرتر و شخصیسازی استراتژیهای درمانی حیاتی است.
جمعبندی و نتیجهگیری
در این مقاله، به بررسی و تحلیل تفاوتهای ساختاری میان سلولهای طبیعی و سلولهای سرطانی پرداختیم و نشان دادیم که تغییرات ساختاری در سلولهای سرطانی چگونه روند بیماری را تحت تأثیر قرار میدهند.
سلولهای طبیعی با ساختاری منظم و کنترل شده، وظایف حیاتی خود را در چارچوب هومئوستاز حفظ میکنند، اما سلولهای سرطانی با دگرگونیهای گسترده در ساختار غشایی، اسکلت سلولی و هسته، توانایی رشد بیرویه، فرار از مرگ برنامهریزی شده و مهاجرت به سایر نقاط بدن را پیدا میکنند.
میکرومحیط تومور نیز نقش بسیار مهمی در تغییرات سلولی دارد؛ ترکیب پیچیدهای از سلولهای ایمنی، فیبروبلاستها، رگهای خونی و ماتریکس خارج سلولی که به صورت پویا با سلولهای سرطانی تعامل میکند و مسیر تکامل تومور را شکل میدهد.
در سطح مولکولی و ژنتیکی، جهشهای متعدد، تغییرات اپیژنتیکی و فعال شدن مسیرهای سیگنالینگ خاص، سبب بازبرنامهریزی سلولی میشوند که منجر به تغییرات ساختاری و عملکردی گستردهای میگردد. این تغییرات، پیامدهای قابل توجهی بر رفتار تومور و پاسخ به درمان دارند.
با درک عمیقتر این فرآیندها، میتوانیم به طراحی درمانهای هدفمندتر و کارآمدتر امیدوار باشیم که نه تنها رشد سلولهای سرطانی را مهار کنند، بلکه مقاومت به درمان و روند متاستاز را نیز کاهش دهند.
نتیجهگیری کلی
شناخت دقیق ساختار و رفتار سلولهای سرطانی، پایه و اساس پیشرفتهای علمی و بالینی در زمینه سرطان است. این دانش به ما امکان میدهد تا مسیرهای جدیدی برای تشخیص زودهنگام، درمانهای شخصیسازی شده و بهبود کیفیت زندگی بیماران سرطانی بیابیم.
تلاشهای تحقیقاتی مستمر و استفاده از فناوریهای نوین، به ویژه در زمینه بررسیهای تکسلولی و میکرومحیط، نقش کلیدی در بهبود نتایج درمان سرطان خواهند داشت.
