آپوپتوز چیست؟
مقدمه کلی بر آپوپتوز و اهمیت آن در زیستشناسی و پزشکی
آپوپتوز یا همان مرگ برنامهریزیشده سلول، یکی از بنیادیترین و ظریفترین فرآیندهای زیستی در موجودات چندسلولی است که با هدف حفظ سلامت و تعادل در بافتها انجام میشود. در این فرآیند، سلولها به شکلی کاملاً کنترلشده و منظم از چرخه حیات خود خارج میشوند، بدون آنکه واکنش التهابی شدیدی در بافت ایجاد کنند. این ویژگی مهم، آپوپتوز را از نکروز که نوعی مرگ سلولی آسیبزا و همراه با التهاب است، متمایز میکند.
این فرآیند نهتنها در رشد و تکامل موجودات زنده، بلکه در حفظ هموستاز بافتی و مقابله با بیماریها نقش اساسی دارد. از بین بردن سلولهای پیر، آسیبدیده یا غیرطبیعی، برای جلوگیری از اختلالات جدی در بدن ضروری است و آپوپتوز دقیقاً همین وظیفه را بر عهده دارد.
تعریف علمی و ریشه واژه
واژه «Apoptosis» نخستینبار در سال ۱۹۷۲ توسط Kerr، Wyllie و Currie معرفی شد. این واژه از زبان یونانی گرفته شده و به معنای «افتادن برگ از درخت» است؛ استعارهای زیبا که به خروج سلولها از سیستم زنده بدون ایجاد آسیب گسترده اشاره دارد. در تعریف علمی، آپوپتوز مجموعهای از تغییرات بیوشیمیایی و مورفولوژیک است که منجر به خرد شدن کنترلشده سلول و پاکسازی سریع بقایای آن توسط سلولهای فاگوسیت میشود.
تفاوت آپوپتوز با دیگر انواع مرگ سلولی
در موجودات زنده، مرگ سلولی میتواند از مسیرهای مختلفی رخ دهد. نکروز معمولاً نتیجه آسیب شدید فیزیکی، شیمیایی یا عفونی است و با تورم سلول، ترکیدن غشا و واکنشهای التهابی گسترده همراه است. در مقابل، آپوپتوز یک فرآیند فعال و انرژیبر است که سلول در آن بهطور «داوطلبانه» به مرگ تن میدهد. علاوه بر این، اتوفاژی و نکروپتوز نیز مسیرهای دیگر مرگ سلولی هستند که از نظر مولکولی و فیزیولوژیکی با آپوپتوز تفاوت دارند، اما گاهی با آن در تعامل قرار میگیرند.
اهمیت آپوپتوز در حفظ حیات
بدون آپوپتوز، بدن قادر به حذف سلولهایی که DNA آسیبدیده دارند، سلولهای آلوده به ویروس، یا سلولهایی که پیامهای رشد غیرقابلکنترلی دریافت کردهاند، نخواهد بود. این عدم کنترل، میتواند به بروز بیماریهای خطرناکی مانند سرطان، بیماریهای خودایمنی یا اختلالات رشد منجر شود.
از طرف دیگر، آپوپتوز بیشازحد نیز مضر است و میتواند به از بین رفتن غیرضروری سلولهای سالم و بروز بیماریهای تحلیلبرنده عصبی، اختلالات قلبی یا تخریب بافتی بینجامد. بنابراین، تعادل ظریف بین فعالسازی و مهار آپوپتوز برای سلامت موجود زنده حیاتی است.
نقش آپوپتوز در تکامل و رشد
در دوران جنینی، آپوپتوز برای شکلگیری ساختارهای بدن نقش اساسی دارد. بهعنوان مثال، تشکیل انگشتان دست و پا در جنین انسان با مرگ برنامهریزیشده سلولهای بین انگشتان انجام میشود. در سیستم عصبی نیز، آپوپتوز باعث حذف نورونهای اضافی و بهینهسازی ارتباطات عصبی میشود.
نگاه بالینی به آپوپتوز
از دیدگاه پزشکی، آپوپتوز هم یک متحد ارزشمند و هم یک دشمن بالقوه است. در درمان سرطان، القای آپوپتوز در سلولهای توموری یک استراتژی مهم است. بسیاری از داروهای ضدسرطان، از جمله ترکیبات شیمیدرمانی و عوامل هدفمند، بر همین اساس عمل میکنند. در مقابل، در بیماریهایی مانند آلزایمر یا بیماری پارکینسون، جلوگیری از آپوپتوز غیرضروری میتواند پیشرفت تخریب سلولهای عصبی را کند کند.
چشمانداز پژوهشی
امروزه آپوپتوز نهتنها در زیستشناسی سلولی و مولکولی، بلکه در ایمونولوژی، انکولوژی، نوروساینس و حتی پزشکی بازساختی موضوع تحقیقات گسترده است. شناخت دقیق مسیرها و مولکولهای درگیر در این فرآیند، میتواند راهکارهای درمانی نوینی برای طیف وسیعی از بیماریها فراهم کند.
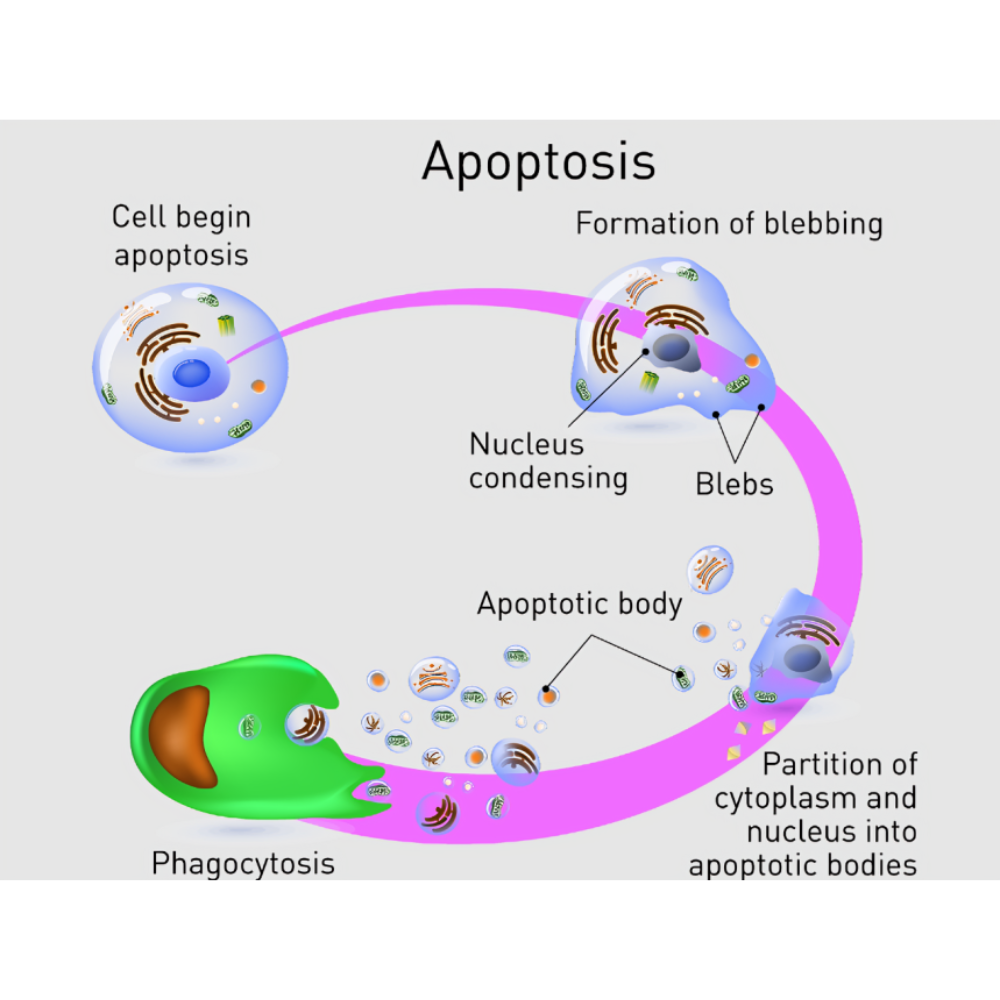
مروری بر ویژگیهای مورفولوژیک آپوپتوز
آپوپتوز نهتنها از نظر مولکولی یک فرآیند دقیق و برنامهریزیشده است، بلکه از نظر ظاهری نیز تغییرات مشخص و قابلمشاهدهای در سلول ایجاد میکند. این تغییرات که به آنها ویژگیهای مورفولوژیک آپوپتوز گفته میشود، حاصل فعالیتهای هماهنگ پروتئینها و آنزیمهای اختصاصی هستند و به دانشمندان اجازه میدهند تا با استفاده از روشهای میکروسکوپی، وقوع این نوع مرگ سلولی را شناسایی کنند.
تغییرات اولیه در شکل سلول
در مراحل آغازین آپوپتوز، سلول شروع به کوچک شدن میکند؛ پدیدهای که به آن سلولکوچکشدگی (cell shrinkage) گفته میشود. در این حالت، سیتوپلاسم غلیظتر میشود و غشای سلولی هنوز سالم باقی میماند. این تفاوت مهمی با نکروز دارد که در آن سلول معمولاً دچار تورم میشود.
تغییرات در غشای سلولی
یکی از شاخصترین تغییرات آپوپتوز، برآمدگیهای غشایی (membrane blebbing) است. این برآمدگیها به دلیل تغییرات در اسکلت سلولی (cytoskeleton) و جابجایی پروتئینهای ساختاری رخ میدهند. علاوه بر این، در طی آپوپتوز، مولکول فسفاتیدیلسرین (phosphatidylserine) که بهطور طبیعی در لایه داخلی غشای پلاسمایی قرار دارد، به سطح خارجی غشا منتقل میشود. این رویداد، یک سیگنال «بخور مرا» برای سلولهای فاگوسیت است تا بقایای سلولی را بهسرعت پاکسازی کنند.
تغییرات در هسته سلول
آپوپتوز با تغییرات بارز در هسته سلول همراه است. چگالی کروماتین (chromatin condensation) افزایش مییابد و DNA به بخشهای کوچکی تجزیه میشود؛ فرآیندی که تحت کنترل آنزیمهای کاسپاز-فعال DNase (CAD) انجام میشود. این پدیده باعث شکلگیری هستههای قطعهقطعه شده (nuclear fragmentation) میگردد. این تغییرات با رنگآمیزیهای اختصاصی مانند DAPI یا Hoechst بهوضوح قابل مشاهده هستند.
تشکیل اجسام آپوپتوتیک
در مراحل پایانی آپوپتوز، سلول به قطعات کوچک غشادار به نام اجسام آپوپتوتیک (apoptotic bodies) تقسیم میشود. هر یک از این اجسام ممکن است حاوی بخشهایی از سیتوپلاسم، اندامکها و قطعات هستهای باشد. این اجسام بهسرعت توسط ماکروفاژها یا سلولهای مجاور فاگوسیتوز میشوند، بدون اینکه پاسخ التهابی شدیدی ایجاد کنند.
حذف بدون التهاب
یکی از ویژگیهای کلیدی آپوپتوز این است که پاکسازی بقایای سلولی بدون تحریک سیستم ایمنی و ایجاد التهاب انجام میشود. این امر به دلیل حفظ یکپارچگی غشا تا مراحل پایانی و وجود سیگنالهای شیمیایی خاص برای جذب سلولهای فاگوسیت است.
تمایز آپوپتوز از سایر انواع مرگ سلولی از نظر ظاهری
-
در نکروز، سلولها متورم و غشای آنها پاره میشود که منجر به آزاد شدن محتویات و تحریک التهاب میگردد.
-
در اتوفاژی، سلول اندامکها و بخشهایی از سیتوپلاسم خود را در واکوئلهای دوغشایی تجزیه میکند، بدون قطعهقطعه شدن هسته به شیوه آپوپتوز.
-
در نکروپتوز، ویژگیهایی بین نکروز و آپوپتوز دیده میشود، اما فقدان کنترل دقیق در مقایسه با آپوپتوز مشهود است.
اهمیت شناسایی ویژگیهای مورفولوژیک در تحقیقات
در مطالعات زیستپزشکی، تشخیص این ویژگیهای ظاهری آپوپتوز اهمیت بالایی دارد. پژوهشگران از این تغییرات برای ارزیابی اثر داروها، مطالعه مکانیسمهای مولکولی بیماریها و بررسی پاسخ سلولها به تنشها استفاده میکنند. به همین دلیل، روشهای میکروسکوپی نوری، فلورسانس و الکترونی، همراه با روشهای مولکولی، معمولاً بهصورت ترکیبی به کار میروند تا اطمینان حاصل شود که مرگ سلولی مشاهدهشده واقعاً آپوپتوز است.
مکانیسمهای اصلی آپوپتوز
آپوپتوز یک فرآیند فعال و وابسته به انرژی است که تحت کنترل دقیق شبکهای از پروتئینها و مسیرهای سیگنالی قرار دارد. بهطور کلی، دو مسیر اصلی برای فعالسازی آپوپتوز شناخته شده است: مسیر ذاتی یا میتوکندریایی و مسیر بیرونی یا وابسته به گیرنده مرگ. علاوه بر این دو، مسیرهای دیگری مانند آپوپتوز وابسته به استرس شبکه آندوپلاسمی و مسیرهای ترکیبی نیز وجود دارند که در شرایط خاص فعال میشوند.
مسیر ذاتی یا میتوکندریایی
این مسیر، که به آن مسیر درونزاد آپوپتوز هم گفته میشود، در پاسخ به آسیبهای درونسلولی فعال میشود. محرکهایی مانند آسیب DNA ، استرس اکسیداتیو، کمبود فاکتورهای رشد، هیپوکسی و تجمع پروتئینهای نادرست تاخورده میتوانند این مسیر را آغاز کنند.
کلید اصلی این مسیر، میتوکندری است. در شرایط استرس سلولی، تعادل میان پروتئینهای طرفدار آپوپتوز )مانند Bax، Bak و (Bid و ضد آپوپتوز (مانند Bcl-2 و Bcl-xL) به نفع فعالسازی آپوپتوز تغییر میکند. پروتئینهای طرفدار آپوپتوز باعث نفوذپذیری غشای خارجی میتوکندری میشوند و این امر به آزادسازی مولکولهای مهمی مانند سیتوکروم c، Smac/DIABLO و AIF (Apoptosis-inducing factor) منجر میشود.
سیتوکروم c آزادشده با پروتئینهای Apaf-1 و پروکاسپاز-9 کمپلکسی به نام آپاپتوزوم تشکیل میدهد. این کمپلکس پروکاسپاز-9 را به شکل فعالش تبدیل کرده و در نهایت کاسپازهای اجرایی مانند کاسپاز-3، کاسپاز-6 و کاسپاز-7 را فعال میکند که تجزیه ساختارهای سلولی را بر عهده دارند.
مسیر بیرونی یا وابسته به گیرنده مرگ
این مسیر، که به آن مسیر برونزاد آپوپتوز نیز گفته میشود، توسط سیگنالهای خارجسلولی آغاز میشود. این سیگنالها معمولاً از طریق گیرندههای مرگ (death receptors) که روی غشای سلول قرار دارند، عمل میکنند.
مهمترین گیرندههای مرگ عبارتند از:
-
Fas (CD95)
-
گیرندههای TNF (Tumor Necrosis Factor receptors)
-
گیرندههای TRAIL (TNF-related apoptosis-inducing ligand)
زمانی که لیگاندهای مربوطه (مانند FasL یا TRAIL) به این گیرندهها متصل میشوند، کمپلکسی به نام DISC (Death-Inducing Signaling Complex) شکل میگیرد که شامل FADD (Fas-associated death domain) و پروکاسپاز-8 یا پروکاسپاز-10 است.
فعالسازی کاسپاز-8 یا کاسپاز-10 مستقیماً کاسپازهای اجرایی را فعال میکند. در برخی موارد، کاسپاز-8 میتواند پروتئین Bid را برش دهد و آن را به شکل فعالش (tBid) تبدیل کند، که سپس مسیر میتوکندریایی را نیز تحریک میکند. این ارتباط باعث میشود دو مسیر ذاتی و بیرونی به هم متصل شوند.
مسیر وابسته به استرس شبکه آندوپلاسمی (ER stress-induced apoptosis)
شبکه آندوپلاسمی مسئول تاخوردگی و پردازش صحیح پروتئینهاست. تجمع پروتئینهای بدتاخورده یا شرایطی مانند کمبود کلسیم، هیپوکسی و استرس اکسیداتیو میتوانند باعث فعالسازی پاسخ موسوم به UPR (Unfolded Protein Response) شوند. اگر این پاسخ نتواند تعادل را بازگرداند، مسیر آپوپتوز فعال میشود.
در این حالت، پروتئینهایی مانند CHOP (C/EBP homologous protein)، کاسپاز-12 (در پستانداران)، و مسیرهای وابسته به JNK (c-Jun N-terminal kinase) در القای مرگ سلولی نقش دارند.
نقاط اتصال و تعامل مسیرها
اگرچه مسیر ذاتی و بیرونی دو راه جداگانه برای القای آپوپتوز محسوب میشوند، اما در بسیاری از شرایط همپوشانی و تعامل بین آنها وجود دارد. مثلاً فعالسازی کاسپاز-8 در مسیر بیرونی میتواند با فعالکردن Bid، نفوذپذیری میتوکندری را افزایش دهد و مسیر ذاتی را تحریک کند. برعکس، آزادسازی فاکتورهایی از میتوکندری میتواند بر گیرندههای مرگ تأثیر غیرمستقیم بگذارد.
نقش کاسپازها در اجرای مرگ سلولی
کاسپازها (Cysteine-aspartic proteases) خانوادهای از آنزیمهای پروتئولیتیک هستند که به دو دسته اصلی تقسیم میشوند:
-
کاسپازهای آغازگر (مانند کاسپاز-8، کاسپاز-9) که سیگنال مرگ را دریافت و پردازش میکنند.
-
کاسپازهای اجرایی )مانند کاسپاز-3، کاسپاز-6 و کاسپاز-7) که پروتئینهای ساختاری و آنزیمهای حیاتی سلول را تخریب میکنند.
فعالیت این آنزیمها منجر به خرد شدن DNA، تخریب اسکلت سلولی، قطعهقطعه شدن هسته و تشکیل اجسام آپوپتوتیک میشود.
مولکولها و ژنهای کلیدی در تنظیم آپوپتوز
فرآیند آپوپتوز تحت کنترل دقیق مجموعهای از پروتئینها، ژنها و فاکتورهای تنظیمی انجام میشود که یا نقش فعالسازی و پیشبرد این مسیر را بر عهده دارند یا بهعنوان مهارکننده عمل میکنند. این تعادل ظریف میان عوامل طرفدار آپوپتوز و عوامل ضد آپوپتوز، سرنوشت سلول را مشخص میکند. شناخت این مولکولها نهتنها برای درک زیستشناسی سلولی ضروری است، بلکه در طراحی داروهای هدفمند، بهویژه در درمان سرطان و بیماریهای تحلیلبرنده، کاربرد گستردهای دارد.
خانواده پروتئینهای BCL-2
خانواده BCL-2 از مهمترین تنظیمکنندههای مسیر ذاتی آپوپتوز هستند و شامل دو گروه عمده میشوند:
-
پروتئینهای ضد آپوپتوز مانند BCL-2، BCL-xL، MCL-1، BCL-w که با حفظ یکپارچگی غشای خارجی میتوکندری، از آزادسازی سیتوکروم c جلوگیری میکنند.
-
پروتئینهای طرفدار آپوپتوز شامل دو زیرگروه:
-
پروتئینهای دارای چندین دامنه BH مانند Bax، Bak که مستقیماً نفوذپذیری غشای میتوکندری را افزایش میدهند.
-
پروتئینهای حاوی تنها دامنه BH3 مانند Bid، Bad، Bim، Puma، Noxa که بهطور غیرمستقیم پروتئینهای ضد آپوپتوز را مهار کرده یا Bax و Bak را فعال میکنند.
-
نسبت بین پروتئینهای طرفدار و ضد آپوپتوز یک معیار تعیینکننده برای ورود یا عدم ورود سلول به مسیر مرگ برنامهریزیشده است.
کاسپازها (Caspases)
کاسپازها خانوادهای از آنزیمهای پروتئولیتیک هستند که با برش اختصاصی پروتئینها در جایگاه اسید آسپارتیک، تغییرات ساختاری لازم برای تخریب سلول را ایجاد میکنند. این آنزیمها در حالت غیرفعال (پروکاسپاز) در سلول وجود دارند و پس از دریافت سیگنال مرگ، به شکل فعال درمیآیند.
-
کاسپازهای آغازگر مانند کاسپاز-8، کاسپاز-9 و کاسپاز-10، سیگنال مرگ را دریافت و پردازش کرده و کاسپازهای اجرایی را فعال میکنند.
-
کاسپازهای اجرایی مانند کاسپاز-3، کاسپاز-6 و کاسپاز-7، اجزای کلیدی سلول مانند اسکلت سلولی، پروتئینهای هسته و آنزیمهای حیاتی را تخریب میکنند.
پروتئین p53 نگهبان ژنوم
p53 یک فاکتور رونویسی حیاتی است که در پاسخ به آسیب DNA یا استرسهای سلولی، مسیر آپوپتوز را فعال میکند. این پروتئین با القای بیان ژنهای طرفدار آپوپتوز مانند Bax، Puma و Noxa و سرکوب ژنهای ضد آپوپتوز، تعادل را به سمت مرگ سلولی هدایت میکند.
در بسیاری از سرطانها، جهش در ژن TP53 منجر به غیرفعالشدن p53 میشود که یکی از مهمترین دلایل مقاومت سلولهای سرطانی به آپوپتوز است.
فاکتورهای رونویسی و مسیرهای سیگنالدهی
علاوه بر p53، مسیرهای سیگنالدهی دیگری نیز در تنظیم آپوپتوز نقش دارند:
-
: NF-κB میتواند بسته به شرایط، هم نقش ضد آپوپتوز و هم طرفدار آپوپتوز داشته باشد.
-
: ATF3پروتئینی که بسته به نوع سلول و محرک، در القا یا مهار آپوپتوز نقش دوگانه ایفا میکند.
-
: FOXO گروهی از فاکتورهای رونویسی که در شرایط استرس اکسیداتیو میتوانند ژنهای طرفدار آپوپتوز را فعال کنند.
پروتئینهای مهارکننده آپوپتوز (IAPs)
خانواده IAP (Inhibitor of Apoptosis Proteins) شامل پروتئینهایی مانند XIAP، c-IAP1، c-IAP2 هستند که با اتصال مستقیم به کاسپازها، فعالیت آنها را مهار میکنند. پروتئینهای Smac/DIABLO و Omi/HtrA2 که از میتوکندری آزاد میشوند، این مهارکنندهها را غیرفعال کرده و مسیر مرگ را پیش میبرند.
پروتئینهای مسیر گیرنده مرگ
در مسیر بیرونی، گیرندههای مرگ مانند Fas و DR4/DR5 و آداپتورهای آنها (مانند FADD و TRADD) نقش کلیدی دارند. این پروتئینها با فعالسازی کاسپازهای آغازگر، سیگنال مرگ را به بخش اجرایی منتقل میکنند.
تعامل مولکولی در شبکه آپوپتوز
فرآیند آپوپتوز حاصل یک شبکه پیچیده از تعاملات پروتئینی است. تغییر در بیان یا فعالیت تنها یک مولکول میتواند تعادل این شبکه را به هم زده و باعث افزایش یا کاهش حساسیت سلول به مرگ شود. به همین دلیل، بسیاری از داروهای ضدسرطان بر پایه تنظیم مجدد این شبکه پروتئینی طراحی میشوند.
تنظیم مثبت و منفی آپوپتوز
آپوپتوز یک فرآیند به شدت تنظیمشده و کنترلشده است که تعادل بین بقای سلولی و مرگ برنامهریزیشده را حفظ میکند. این تعادل از طریق مجموعهای از سیگنالها و پروتئینها که بهعنوان تنظیمکنندههای مثبت و منفی عمل میکنند، برقرار میشود. تغییر در عملکرد این عوامل میتواند باعث بروز بیماریهایی همچون سرطان، بیماریهای خودایمنی یا اختلالات تخریب عصبی شود.
تنظیم مثبت آپوپتوز
تنظیم مثبت به عواملی اشاره دارد که باعث فعالسازی مسیرهای آپوپتوز و در نتیجه مرگ سلول میشوند. این تنظیمکنندهها شامل پروتئینها و سیگنالهایی هستند که بهطور مستقیم یا غیرمستقیم کاسپازها را فعال کرده و مسیرهای ذاتی یا بیرونی را تحریک میکنند. از جمله مهمترین عوامل تنظیم مثبت میتوان به موارد زیر اشاره کرد:
-
پروتئینهای خانواده Bcl-2 با عملکرد پروموتور مرگ (Pro-apoptotic) مانند Bax ، Bak و Bid که با نفوذ به غشای میتوکندری، آزادسازی سیتوکروم c را تسهیل میکنند.
-
کاسپازهای آغازگر مانند Caspase-8 و Caspase-9 که با فعالسازی کاسپازهای اجرایی، فرآیند مرگ سلولی را شروع میکنند.
-
فاکتورهای رونویسی نظیر p53 که در پاسخ به آسیب DNA ، بیان ژنهای پروموتور آپوپتوز را افزایش میدهند.
-
سیگنالهای خارج سلولی شامل لیگاندهای خانواده TNF (مانند FasL و (TRAILکه با اتصال به گیرندههای مرگ، مسیر بیرونی آپوپتوز را فعال میکنند.
تنظیم منفی آپوپتوز
تنظیم منفی به عواملی اشاره دارد که باعث مهار یا تأخیر در وقوع آپوپتوز میشوند و نقش مهمی در بقا و ترمیم سلولی ایفا میکنند. اختلال در این مسیرها میتواند موجب تداوم بقای سلولهای غیرطبیعی و پیشرفت سرطان شود. مهمترین عوامل تنظیم منفی عبارتند از:
-
پروتئینهای ضدآپوتوتیک خانواده Bcl-2 مانند Bcl-2 و Bcl-xL که از آزادسازی سیتوکروم c از میتوکندری جلوگیری میکنند.
-
پروتئینهای مهارکننده کاسپازها (IAPs) که با اتصال مستقیم به کاسپازها، از فعالشدن آنها جلوگیری میکنند.
-
سیگنالهای بقا مانند مسیر PI3K/Akt که با فسفریلهکردن پروتئینهای پروموتور مرگ، آنها را غیرفعال میسازد.
-
فاکتورهای رشد و هورمونها که با فعالسازی مسیرهای ضدآپوپتوزی، طول عمر سلول را افزایش میدهند.
تعادل بین تنظیم مثبت و منفی
بقای سلولها نتیجه یک تعادل ظریف میان این دو دسته عوامل است. در شرایط فیزیولوژیک، این تعادل به گونهای تنظیم میشود که سلولهای آسیبدیده یا غیرضروری به موقع حذف شوند و سلولهای سالم حفظ گردند. در شرایط پاتولوژیک، غلبه عوامل تنظیم منفی میتواند به فرار سلولها از مرگ منجر شود، در حالی که غلبه عوامل تنظیم مثبت ممکن است باعث از بین رفتن سلولهای حیاتی و بروز بیماریهای تخریبکننده بافتی گردد.
آپوپتوز در فیزیولوژی بدن انسان
آپوپتوز نهتنها یک مکانیسم حذف سلولهای آسیبدیده یا غیرضروری است، بلکه نقش بنیادینی در حفظ هموستاز بافتی و رشد و تکامل طبیعی بدن انسان ایفا میکند. این فرآیند در طول عمر، از مراحل اولیه جنینی تا بزرگسالی و پیری، بهعنوان یک سامانه تنظیمی دقیق عمل میکند و با کنترل تعداد و کیفیت سلولها، سلامت کلی ارگانها را تضمین مینماید.
نقش آپوپتوز در رشد و نمو جنینی
در دوران جنینی، آپوپتوز یک ابزار اساسی برای شکلدهی ساختارها و اندامهاست. حذف انتخابی سلولها، مسیر شکلگیری اندامها را هدایت میکند. نمونه بارز این نقش، حذف پرده بین انگشتان در اندامهای در حال رشد جنین است که به شکلگیری انگشتان جدا از هم منجر میشود. همچنین، آپوپتوز در تنظیم تعداد نورونها و ایجاد اتصالات عصبی کارآمد در سیستم عصبی مرکزی جنین نقشی کلیدی دارد.
آپوپتوز در حفظ بافتها و اندامها
در بدن انسان بالغ، آپوپتوز بهطور مداوم سلولهای فرسوده یا آسیبدیده را حذف میکند و جای آنها را به سلولهای جدید میدهد. این چرخه برای بافتهایی با نرخ بازسازی بالا مانند پوست، مخاط دستگاه گوارش و سلولهای خونی حیاتی است. بهعنوان مثال، در مغز استخوان روزانه میلیونها سلول خونی تولید و بهطور همزمان از طریق آپوپتوز حذف میشوند تا تعادل سلولی حفظ شود.
نقش آپوپتوز در سیستم ایمنی
آپوپتوز یک مکانیسم اساسی برای کنترل فعالیت سلولهای ایمنی است. پس از پایان یک پاسخ ایمنی، بسیاری از لنفوسیتهای فعالشده از طریق آپوپتوز حذف میشوند تا از التهاب مزمن یا خودایمنی جلوگیری شود. علاوه بر این، آپوپتوز در حذف لنفوسیتهای خودواکنشگر در تیموس نقش مهمی دارد و از حمله سیستم ایمنی به بافتهای خودی پیشگیری میکند.
آپوپتوز در حذف سلولهای غیرطبیعی
یکی از جنبههای حیاتی آپوپتوز، توانایی آن در حذف سلولهایی است که دچار آسیب ژنتیکی یا جهشهای خطرناک شدهاند. این عملکرد بهعنوان یک مکانیسم ضدسرطانی طبیعی عمل کرده و از تجمع سلولهای بالقوه بدخیم جلوگیری میکند.
هماهنگی آپوپتوز با سایر فرآیندهای فیزیولوژیک
آپوپتوز بهطور هماهنگ با فرآیندهایی مانند اتوفرژی و نکروز کنترلشده در تنظیم سرنوشت سلولها فعالیت میکند. این هماهنگی برای جلوگیری از آسیب بافتی و حفظ کارایی اندامها ضروری است.
آپوپتوز در پاتولوژی و بیماریها
اختلال در فرآیند آپوپتوز، چه بهصورت کاهش بیشازحد و چه بهصورت افزایش غیرطبیعی، میتواند زمینهساز بروز طیف گستردهای از بیماریها شود. از آنجا که آپوپتوز بهعنوان یک سامانه حیاتی برای حفظ تعادل سلولی عمل میکند، هرگونه تغییر در مسیرهای مولکولی آن میتواند پیامدهای جدی برای سلامت انسان به همراه داشته باشد.
کاهش آپوپتوز و بیماریهای ناشی از آن
کاهش فعالیت آپوپتوز معمولاً با سرطان و بیماریهای مرتبط با تجمع سلولهای غیرطبیعی همراه است. هنگامیکه سلولهای دارای آسیب DNA یا جهشهای خطرناک از طریق آپوپتوز حذف نشوند، این سلولها میتوانند از کنترل چرخه سلولی بگریزند و بهتدریج تومور تشکیل دهند. بسیاری از تومورها با بیان بیشازحد پروتئینهای ضدآپوپتوزی مانند Bcl-2 یا کاهش فعالیت پروتئینهای پروآپوپتوتیک مثل Bax و p53، مکانیسم مرگ برنامهریزیشده را مختل میکنند.
افزایش بیشازحد آپوپتوز و بیماریهای مرتبط
برخلاف حالت قبل، افزایش غیرطبیعی آپوپتوز میتواند به تخریب پیشرونده بافتها و بیماریهای دژنراتیو منجر شود. در بیماریهای عصبی مانند آلزایمر، پارکینسون و هانتینگتون، فعالشدن بیشازحد مسیرهای آپوپتوز موجب مرگ گسترده نورونها و اختلال در عملکرد شبکههای عصبی میشود. همچنین، در بیماریهای قلبی-عروقی مانند نارسایی قلبی یا آسیب ایسکمیک، آپوپتوز نقش مهمی در از بین رفتن سلولهای عضلانی قلب دارد.
آپوپتوز و بیماریهای خودایمنی
در برخی بیماریهای خودایمنی، آپوپتوز یا به اندازه کافی سلولهای ایمنی خودواکنشگر را حذف نمیکند، یا برعکس، مرگ بیشازحد سلولهای تنظیمکننده ایمنی باعث برهمخوردن تعادل سیستم ایمنی میشود. این وضعیت میتواند به ایجاد پاسخهای ایمنی غیرکنترلشده و آسیب به بافتهای سالم منجر گردد.
عفونتها و آپوپتوز
پاتوژنها، بهویژه ویروسها و برخی باکتریها، میتوانند از طریق مهار یا تحریک مسیرهای آپوپتوز بقای خود را تضمین کنند. برخی ویروسها مانند ویروس اپشتین–بار یا ویروس هرپس با مهار آپوپتوز، اجازه تکثیر طولانیمدت خود را در سلولهای میزبان میدهند. در مقابل، برخی باکتریها با فعالکردن بیشازحد آپوپتوز در سلولهای ایمنی، به تضعیف دفاع میزبان کمک میکنند.
اهمیت بالینی و درمانی
شناخت دقیق نقش آپوپتوز در بیماریها، زمینه را برای توسعه درمانهای هدفمند فراهم کرده است. در سرطان، داروهایی طراحی میشوند که مسیرهای آپوپتوز را دوباره فعال کنند، درحالیکه در بیماریهای دژنراتیو یا ایسکمیک، راهبردها بر مهار کنترلشده آپوپتوز متمرکز هستند تا از مرگ غیرضروری سلولها جلوگیری شود.
راهکارهای هدفگیری آپوپتوز در درمان بیماریها
پیشرفت دانش در زمینه مکانیسمهای مولکولی آپوپتوز، امکان طراحی رویکردهای درمانی هدفمند را فراهم کرده است که میتوانند فرآیند مرگ برنامهریزیشده سلولی را به نفع سلامت بیمار تنظیم کنند. این راهکارها بسته به نوع بیماری، ممکن است با فعالسازی آپوپتوز برای حذف سلولهای غیرطبیعی یا با مهار آن برای جلوگیری از مرگ سلولهای سالم بهکار روند.
فعالسازی آپوپتوز در درمان سرطان
در بسیاری از سرطانها، مسیرهای آپوپتوتیک به دلیل بیان بیشازحد پروتئینهای ضدآپوپتوزی یا غیرفعال شدن پروتئینهای کلیدی مانند p53 مختل میشوند. راهبردهای درمانی در این زمینه شامل:
-
مهارکنندههای Bcl-2 مانند Venetoclax که با مسدود کردن پروتئینهای ضدآپوپتوزی، توانایی سلولهای سرطانی برای بقا را کاهش میدهند.
-
مولکولهای فعالکننده مسیر p53 که از طریق بازگرداندن عملکرد این پروتئین، پاسخ آپوپتوتیک را در سلولهای توموری تحریک میکنند.
-
آگونیستهای گیرندههای مرگ (Death Receptor Agonists) که مسیرهای خارجی آپوپتوز را فعال میکنند.
مهار آپوپتوز در بیماریهای دژنراتیو و ایسکمیک
در شرایطی مانند بیماری آلزایمر، پارکینسون، سکته مغزی یا آسیب ایسکمیک قلبی، هدف درمانی، کاهش مرگ غیرضروری سلولها است. این رویکرد شامل:
-
مهارکنندههای کاسپاز که با مسدود کردن آنزیمهای کلیدی آپوپتوز، از مرگ سلولهای حیاتی جلوگیری میکنند.
-
آنتیاکسیدانها و پایدارکنندههای میتوکندری که از تخریب غشای میتوکندری و آزاد شدن سیتوکروم c جلوگیری میکنند.
-
تنظیمکنندههای سیگنالدهی بقای سلولی مانند فعالکنندههای مسیر PI3K/Akt که مقاومت سلولها را در برابر استرس افزایش میدهند.
ایمونوتراپی و آپوپتوز
در درمان سرطان و برخی بیماریهای ویروسی، تحریک سیستم ایمنی برای شناسایی و حذف سلولهای غیرطبیعی از طریق آپوپتوز اهمیت بالایی دارد. استفاده از سلولهای T مهندسیشده )مانند CAR-T) و آنتیبادیهای منوکلونال علیه آنتیژنهای توموری، نمونههایی از این رویکرد هستند.
چالشها و چشمانداز آینده
هرچند هدفگیری آپوپتوز در درمان بیماریها امیدبخش است، اما دقت و انتخابپذیری درمان همچنان یک چالش مهم محسوب میشود. فعالسازی یا مهار بیشازحد آپوپتوز میتواند عوارض جانبی جدی ایجاد کند. تحقیقات آینده به سمت توسعه داروهای هوشمند با توانایی پاسخ به شرایط خاص بافت یا تومور و همچنین ترکیب راهکارهای هدفگیری آپوپتوز با درمانهای شخصیسازیشده پیش میرود.
روشهای تشخیص و مطالعه آپوپتوز
بررسی دقیق آپوپتوز در مطالعات سلولی و بافتی نیازمند استفاده از روشهای تحلیلی و آزمایشگاهی تخصصی است که بتوانند تغییرات مولکولی و مورفولوژیک این فرآیند را شناسایی کنند. انتخاب روش مناسب به هدف پژوهش، نوع نمونه، و مرحلهای از آپوپتوز که مدنظر است، بستگی دارد.
بررسی تغییرات مورفولوژیک
یکی از نخستین راهکارها برای شناسایی آپوپتوز، مشاهده تغییرات ظاهری سلولهاست که شامل چروکیده شدن سلول، تراکم کروماتین، و تشکیل اجسام آپوپتوتیک میشود. این تغییرات با استفاده از میکروسکوپ نوری، میکروسکوپ فلورسانس، یا میکروسکوپ الکترونی قابل بررسی هستند.
روش TUNEL (Terminal deoxynucleotidyl transferase dUTP Nick End Labeling)
این آزمون، شکستهای DNA را که از ویژگیهای اصلی آپوپتوز هستند، شناسایی میکند. در این روش، آنزیم TdT نوکلئوتیدهای نشاندار را به انتهای آزاد DNA اضافه میکند و از طریق فلورسانس یا رنگآمیزی آنزیمی قابل مشاهده میشود. مزیت TUNEL حساسیت بالا در شناسایی سلولهای آپوپتوتیک حتی در مراحل پایانی است.
رنگآمیزی Annexin V
در مراحل اولیه آپوپتوز، فسفاتیدیلسرین از لایه داخلی غشای سلول به سطح خارجی آن منتقل میشود. Annexin V که تمایل بالایی به فسفاتیدیلسرین دارد، به کمک رنگهای فلورسانس مانند FITC یا پروپیدیوم یدید (PI) برای تمایز بین سلولهای زنده، آپوپتوتیک و نکروتیک بهکار میرود. این روش غالباً با فلوسایتومتری ترکیب میشود.
آزمونهای مبتنی بر فعالیت کاسپازها
کاسپازها آنزیمهای کلیدی در مسیرهای آپوپتوتیک هستند. با استفاده از بسترهای مصنوعی نشاندار که پس از برش توسط کاسپازها سیگنال فلورسانس یا رنگی آزاد میکنند، میتوان فعال شدن آنها را کمیسازی کرد. این آزمونها برای مطالعه دینامیک آپوپتوز در زمان واقعی بسیار کاربردیاند.
الکتروفورز DNA و الگوی نردبانی (DNA Laddering)
تجزیه DNA به قطعات منظم حدود 180–200 جفتباز، از ویژگیهای بارز آپوپتوز است. این قطعات در ژل آگارز به صورت یک الگوی نردبانی مشخص دیده میشوند که نشانه شکستهای دروننوکلئوزومی DNA است.
فلوسایتومتری و آنالیز چرخه سلولی
با رنگآمیزی DNA به کمک پروپیدیوم یدید و تحلیل با فلوسایتومتر، میتوان جمعیت سلولهای Sub-G1 را که نمایانگر محتوای DNA کمتر به دلیل شکستهای آپوپتوتیک است، شناسایی کرد.
ترکیب چند روش برای افزایش دقت
به دلیل اینکه هیچ روش منفردی قادر به ارائه تصویری کامل از آپوپتوز نیست، معمولاً پژوهشگران از ترکیب روشهای مورفولوژیک، بیوشیمیایی و مولکولی استفاده میکنند تا نتایج معتبر و جامعتری بهدست آورند.
آپوپتوز در ارگانیسمهای غیرانسانی
آپوپتوز، گرچه بهطور گسترده در زیستشناسی انسان مطالعه شده است، در بسیاری از ارگانیسمهای غیرانسانی نیز نقش حیاتی دارد. این فرآیند نه تنها در حفظ تعادل سلولی و حذف سلولهای آسیبدیده یا غیرضروری اهمیت دارد، بلکه در تکامل، دفاع ایمنی و تنظیم رشد در گونههای مختلف مؤثر است.
آپوپتوز در جانوران غیرانسانی
در جانوران مهرهدار مانند موشها، ماهیها، و پرندگان، مکانیسمهای آپوپتوز مشابه انسان مشاهده میشود. به عنوان مثال، مسیرهای کاسپازی، پروتئینهای خانواده Bcl-2 و مولکولهای تنظیمکننده دیگر، به صورت ساختاری و عملکردی شباهت زیادی دارند. در مدلهای حیوانی، مطالعه آپوپتوز به درک بیماریها، روند پیری، و پاسخ به داروهای ضدسرطان کمک شایانی کرده است.
در بیمهرگان نیز، آپوپتوز به عنوان یک مکانیسم محافظتی در برابر استرسهای محیطی و تنظیم توسعه بافتها مشاهده میشود. برای نمونه، در حشرات، فرآیند حذف سلولهای اضافی یا آسیبدیده هنگام دگردیسی و توسعه اندامها وابسته به آپوپتوز است.
آپوپتوز در گیاهان
اگرچه در گیاهان مرگ برنامهریزی شده سلولها (Programmed Cell Death یا PCD) مشابه آپوپتوز حیوانی است، برخی تفاوتهای مهم نیز وجود دارد. گیاهان فاقد برخی از مولکولهای کلیدی آپوپتوز حیوانی مانند کاسپازها هستند، اما آنزیمهای مشابهی مثل متاکاسپازها نقش مشابهی ایفا میکنند.
مرگ برنامهریزی شده سلول در گیاهان در فرآیندهایی مانند ایجاد بافت چوبی (زخمپوشی) و پاسخ به تنشهای محیطی از جمله حمله پاتوژنها اهمیت دارد. این مکانیسم به حفظ سلامت کل گیاه و بهبود سازگاری با شرایط نامساعد کمک میکند.
آپوپتوز در میکروارگانیسمها
برخی قارچها و حتی باکتریها نیز اشکالی از مرگ برنامهریزی شده را نشان میدهند که میتوان آن را نوعی آپوپتوز مشابه حیوانات در نظر گرفت. این فرآیندها در تنظیم جمعیت، پاسخ به استرس و کنترل کیفیت ژنتیکی مؤثرند.
اهمیت مطالعه آپوپتوز در ارگانیسمهای غیرانسانی
مطالعه آپوپتوز در گونههای مختلف به درک عمیقتر اصول بنیادی مرگ سلولی کمک میکند و ابزارهای جدیدی برای توسعه داروهای هدفمند، بهبود کشاورزی و مدیریت بیماریها فراهم میآورد. همچنین، فهم این فرآیند در ارگانیسمهای مدل، راهنمایی برای تحقیقات زیستپزشکی و کاربردهای زیستفناوری است.
چالشها و چشماندازهای آینده در مطالعه آپوپتوز
مطالعه آپوپتوز، به عنوان یک فرآیند حیاتی در زیستشناسی و پزشکی، همچنان با چالشهای علمی و فنی قابل توجهی روبهرو است که نیازمند تلاشهای پژوهشی گسترده و نوآوریهای فناوری است. در ادامه به مهمترین این چالشها و چشماندازهای آتی پرداخته میشود.
چالشهای کنونی در مطالعه آپوپتوز
یکی از اصلیترین مشکلات، پیچیدگی و تنوع مسیرهای سیگنالدهی آپوپتوز است. این مسیرها بسته به نوع سلول، شرایط محیطی و گونههای مختلف میتوانند متفاوت باشند و شناخت کامل آنها نیازمند مدلهای آزمایشگاهی متنوع و تکنیکهای دقیق است.
همچنین، تفکیک مرگ آپوپتوتیک از دیگر انواع مرگ سلولی مانند نکروز یا اتوفاژی، خصوصاً در نمونههای بالینی، چالشی بزرگ است. روشهای تشخیصی موجود هنوز به اندازه کافی حساس و اختصاصی نیستند و توسعه ابزارهای دقیقتر برای تشخیص و رصد آپوپتوز در شرایط زنده بسیار ضروری است.
در حوزه درمانی، هدفگیری آپوپتوز برای مقابله با بیماریهایی همچون سرطان یا اختلالات عصبی پیچیدگیهای خاص خود را دارد. یکی از مشکلات، ایجاد تعادل مناسب بین تحریک یا مهار آپوپتوز است، چرا که هرگونه بیتعادلی میتواند به پیامدهای ناخواسته منجر شود.
چشماندازهای آینده در مطالعه آپوپتوز
با پیشرفتهای فناوریهای مولکولی، تصویربرداری سلولی و بیوانفورماتیک، انتظار میرود که شناخت ما از مسیرهای آپوپتوز به سطح جدیدی ارتقا یابد. استفاده از هوش مصنوعی و الگوریتمهای یادگیری ماشین برای تحلیل دادههای بزرگ زیستی میتواند در شناسایی الگوهای مخفی و هدفهای درمانی جدید بسیار مؤثر باشد.
همچنین، توسعه داروهای نسل جدید که بتوانند با دقت بالا، مولکولهای کلیدی مسیر آپوپتوز را هدف قرار دهند، نویدبخش درمانهای شخصیسازی شده و کارآمدتر است. این داروها میتوانند در درمان سرطان، بیماریهای خودایمنی و حتی بیماریهای مزمن عصبی تحول ایجاد کنند.
پیشرفت در روشهای تشخیص زودهنگام آپوپتوز در بافتهای انسانی و ارزیابی دینامیک این فرآیند، امکان نظارت دقیقتر بر روند درمانها را فراهم خواهد کرد و به بهبود نتایج بالینی کمک خواهد نمود.
در نهایت، مطالعه ارتباط آپوپتوز با فرآیندهای دیگر سلولی مانند اتوفاژی و نکروز، و نقش مشترک آنها در حفظ هومئوستاز، میتواند منجر به درک جامعتر و درمانهای نوآورانهتر شود.
نتیجهگیری
آپوتپوز، به عنوان یک پدیده زیستی پیچیده و چندوجهی، هنوز بخشهای ناشناخته بسیاری دارد که با رفع چالشهای فعلی و بهرهگیری از فناوریهای نوین، میتوان به افقهای جدیدی در درک و کاربرد این فرآیند دست یافت. این پیشرفتها نه تنها دانش پایه زیستشناسی را ارتقا میدهند، بلکه چشماندازهای درمانی گستردهای را برای آینده پزشکی رقم خواهند زد.
جمعبندی و نتیجهگیری
آپوپتوز، به عنوان یک فرآیند برنامهریزی شده مرگ سلولی، نقش بسیار حیاتی و پیچیدهای در حفظ سلامت و توازن زیستی ارگانیسمها ایفا میکند. این پدیده نه تنها در توسعه و رشد طبیعی سلولها، بلکه در حذف سلولهای آسیبدیده یا مضر، اهمیت دارد و از بروز بیماریهای مختلف جلوگیری میکند.
در این مقاله، به بررسی مفهوم کلی آپوپتوز، ویژگیهای مورفولوژیکی آن، مکانیسمهای مولکولی و مسیرهای سیگنالدهی مختلف پرداخته شد. همچنین، مولکولها و ژنهای کلیدی در تنظیم این فرآیند تشریح شد و تأکید گردید که تنظیم دقیق آپوپتوز، هم به صورت مثبت و هم منفی، برای حفظ هموستازی و سلامت سلولی ضروری است.
نقش آپوپتوز در فیزیولوژی طبیعی بدن انسان و ارتباط آن با بیماریها، از جمله سرطان، اختلالات عصبی و بیماریهای ایمنی، به طور جامع مورد بررسی قرار گرفت. راهکارهای درمانی نوین که بر پایه هدفگیری مسیرهای آپوپتوز استوارند، چشماندازهای امیدوارکنندهای برای پزشکی شخصیسازیشده و درمان بیماریهای مقاوم فراهم میآورند.
روشهای تشخیص و مطالعه آپوپتوز، به عنوان ابزارهای کلیدی در پژوهشهای بالینی و پایه، معرفی شدند که هرچند پیشرفت قابل توجهی داشتهاند، همچنان نیازمند توسعه و بهبود هستند تا بتوانند به طور دقیق و اختصاصی این فرآیند را در شرایط مختلف بیولوژیکی و بیماریها پایش کنند.
نهایتاً، توجه به آپوپتوز در ارگانیسمهای غیرانسانی، چشماندازی گستردهتر از اهمیت این فرآیند در زیستشناسی تطبیقی ارائه داد و یادآور شد که مطالعات آینده باید با در نظر گرفتن تنوع زیستی، به کشف مکانیسمهای جدید و کاربردهای نوین بپردازند.
چالشها و فرصتهای آینده در مطالعه آپوپتوز، نیازمند همکاریهای میانرشتهای و بهرهگیری از فناوریهای نوین است که میتواند به توسعه درمانهای هدفمند و افزایش دانش بنیادی درباره مرگ سلولی منجر شود.
در نهایت، درک عمیقتر و کاربردیتر آپوپتوز، کلید حل بسیاری از مسائل پزشکی و زیستی پیشرو خواهد بود؛ موضوعی که همچنان به پژوهشهای گسترده و نوآورانه نیاز دارد تا بتواند به سلامت بهتر انسانها و درمان مؤثرتر بیماریها کمک کند.


