اپی ژنتیک چیست؟
اپیژنتیک چیست؟
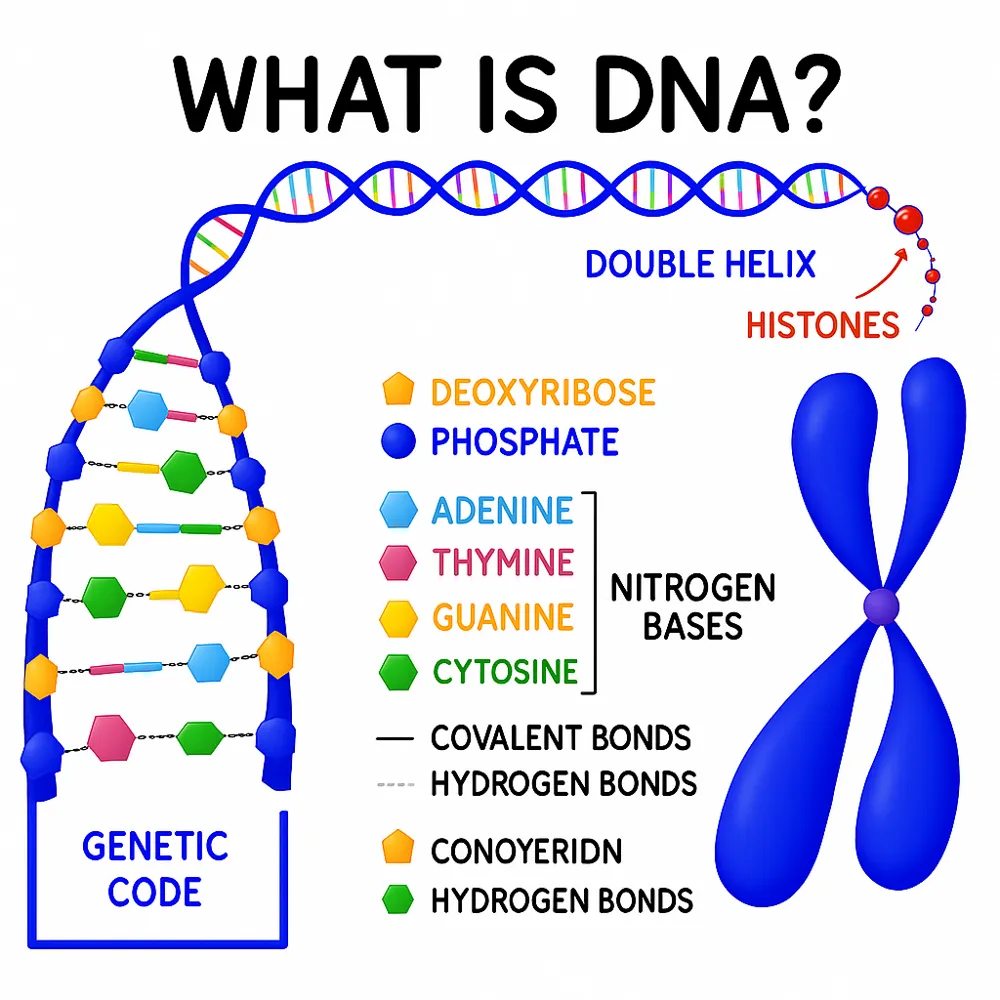
در زیستشناسی، اپیژنتیک (Epigenetics) شاخهای از علم است که به بررسی تغییرات فنوتیپی وراثتی میپردازد؛ تغییراتی که بدون ایجاد تغییر در توالی DNA رخ میدهند. واژهی «اپی» (epi-) از ریشهی یونانی به معنای «بر روی» یا «علاوه بر» است، و در این زمینه به فرآیندهایی اشاره دارد که در لایهای فراتر از اطلاعات ژنتیکی کلاسیک، باعث ایجاد تفاوتهای قابل مشاهده یا عملکردی در موجودات میشوند.
اپیژنتیک شامل مجموعهای از سازوکارهایی است که فعالیت و بیان ژنها را تنظیم میکنند، بدون آنکه توالی اصلی نوکلئوتیدها در DNA تغییر یابد. با این حال، اصطلاح اپیژنتیک میتواند برای توصیف هر نوع تغییر فنوتیپی وراثتی که توالی DNA را تغییر نمیدهد نیز بهکار رود. این تغییرات میتوانند ناشی از عوامل خارجی یا محیطی باشند یا در فرآیند رشد طبیعی یک ارگانیسم نقش داشته باشند.
یکی از مثالهای کلاسیک از تغییرات اپیژنتیکی، روند تمایز سلولی در طی مراحل رشد است. در فرآیند مورفوژنز، سلولهای بنیادی چندتوان (pluripotent stem cells) به انواع مختلفی از سلولهای جنینی تبدیل میشوند و در نهایت به سلولهایی کاملاً متمایز مانند نورونها، سلولهای عضلانی، اپیتلیال، سلولهای اندوتلیال رگهای خونی و سایر سلولهای تخصصیافته تمایز مییابند. این فرآیند مستلزم فعالسازی برخی ژنها و خاموش کردن برخی دیگر در هر نوع سلول خاص است، بدون آنکه در توالی DNA تغییری ایجاد شود.
تفاوت ژنوتیپ و فنوتیپ
فنوتیپ (Phenotype) اصطلاحی در ژنتیک است که به تمام صفات قابل مشاهدهی یک موجود زنده اطلاق میشود. این صفات، نتیجهی تعامل بین ژنوتیپ (مجموعه ژنهای موجود در ژنوم) و محیط هستند. پیشوند «فنو» به معنای دیدن یا مشاهده است و از اینرو فنوتیپ برای توصیف ویژگیهایی بهکار میرود که قابل رؤیت یا اندازهگیری هستند، مانند قد، رنگ چشم، رنگ پوست و سایر ویژگیهای ظاهری یا عملکردی.
فنوتیپ میتواند شامل موارد زیر باشد:
-
مورفولوژی (شکل و ساختار فیزیکی)
-
الگوهای رشد
-
رفتارها
-
ویژگیهای فیزیولوژیکی و زیستی
-
و حتی فرآوردههای شیمیایی خاص یک ارگانیسم
فنوتیپ یک موجود زنده تحت تأثیر دو عامل اصلی است:
-
ژنوتیپ (یا بیان ژنوم)
-
تأثیر محیط بر ژنوم
ترکیب این دو عامل تعیین میکند که یک ویژگی خاص چگونه در بدن یک موجود زنده ظاهر شود. حتی در یک فرد نیز ممکن است به دلیل تغییرات محیطی، فرآیندهای فیزیولوژیکی یا شرایط سنی، تنوعی در فنوتیپ مشاهده شود.
این تنوع فنوتیپی پایه و اساس فرآیند انتخاب طبیعی را تشکیل میدهد. در این فرآیند، محیط زیست بقای افرادی را که دارای فنوتیپهای مناسبتر هستند، بیشتر تضمین میکند. این پدیده را میتوان به وضوح در دوقلوهای همسان مشاهده کرد؛ با آنکه ژنوتیپ یکسانی دارند، ممکن است به دلیل تفاوتهای محیطی یا اپیژنتیکی، فنوتیپهای متفاوتی را بروز دهند.
در واقع، بدون وجود تنوع در فنوتیپ، تکامل بر پایه انتخاب طبیعی امکانپذیر نبود. این تنوع ممکن است حتی در لایههایی پایینتر از ترکیب ژنتیکی نیز عمل کند؛ برای مثال در جهشهای خاموش که اگرچه توالی آمینواسیدها را تغییر نمیدهند، اما با تغییر فراوانی جفت بازهای گوانین–سیتوزین، میتوانند باعث افزایش پایداری حرارتی DNA شوند و در نتیجه، به ارگانیسم کمک کنند در محیطهای گرمتر زنده بماند.
از جمله نمونههای مشخص فنوتیپ در انسان میتوان به مواردی چون گروه خونی، رنگ چشم، بافت مو و برخی بیماریهای ژنتیکی اشاره کرد.
ژنوتیپ چیست؟
ژنوتیپ (Genotype) به محتوای ژنتیکی یا توالی دقیق ژنهای موجود در ژنوم یک موجود زنده اشاره دارد. این اصطلاح همچنین به ترکیب آللهای یک ژن خاص نیز گفته میشود؛ مثلاً ترکیب «Bb» که در آن B نمایانگر آلل غالب و b آلل مغلوب است.
فنوتیپ نهایی یک فرد (خصوصیات ظاهری یا عملکردی او) نتیجهی بیان ژنوتیپ است. اما باید توجه داشت که ژنوتیپ تنها عامل تعیینکنندهی فنوتیپ نیست؛ عوامل محیطی و نیز فرآیندهای اپیژنتیکی نیز نقش مهمی در این موضوع دارند.
ژنوتیپ ممکن است تحت تأثیر انواع جهشها قرار گیرد، از جمله تغییر در توالی نوکلئوتیدها یا فراوانی جفت بازها. با این حال، تنها تغییراتی که در سلولهای جنسی (گامتها) ایجاد شدهاند، به عنوان بخشی از ژنوتیپ ارثپذیر در نظر گرفته میشوند؛ چراکه جهشهایی که صرفاً در سلولهای سوماتیک (غیرجنسی) رخ دهند، قابل انتقال به نسل بعد نیستند و در تعریف ژنوتیپ فرد جای نمیگیرند.
بیان ژنوتیپ به ترکیب آللی آن وابسته است. برای مثال:
-
در صورت حضور یک آلل غالب، ویژگی مربوطه حتی با حضور یک نسخهی مغلوب نیز در فنوتیپ ظاهر خواهد شد.
-
تنها زمانی که هر دو آلل مغلوب باشند، ویژگی مربوطه در فنوتیپ ظاهر نمیشود یا تغییر میکند.
ژنوتیپ برخلاف فنوتیپ، قابل مشاهده نیست و تنها با استفاده از روشهای تخصصی مانند تعیین توالی DNA، PCR (واکنش زنجیرهای پلیمراز) یا RFLP (چندشکلی طول قطعه محدود) قابل بررسی است. به این فرآیندها به طور کلی ژنوتایپینگ (Genotyping) گفته میشود که برای مطالعات تحقیقاتی، تشخیص بیماریهای ژنتیکی یا انتخاب صفات مطلوب در اصلاح نژاد کاربرد دارد.
نمونههایی از ژنوتیپ و فنوتیپ در حیوانات
-
TT: آلل هموزیگوت غالب برای ویژگی قد بلند
-
Tt: آلل هتروزیگوت برای قد (که در اینجا قد بلند خواهد بود چون T غالب است)
-
BB: آلل هموزیگوت غالب برای رنگ چشم خاص (مثلاً قهوهای)
در نهایت، فنوتیپ نتیجهی قابل مشاهده تعامل ژنوتیپ با محیط و تنظیمهای اپیژنتیکی است؛ در حالی که ژنوتیپ ساختار ژنتیکی ثابت (مگر در صورت بروز جهش) و غیر قابل مشاهدهای است که پایه و اساس فنوتیپ را تشکیل میدهد. اپیژنتیک پلی میان این دو است و نشان میدهد که چگونه ویژگیهای ارثی میتوانند بدون تغییر در DNA، از نسلی به نسل دیگر منتقل شوند.
تکنیکهای مطالعه اپیژنتیک
در مطالعات اپیژنتیکی، بهمنظور درک دقیقتر پدیدههای اپیژنتیکی، از طیف وسیعی از تکنیکهای مولکولی استفاده میشود. برخی از مهمترین این روشها عبارتاند از:
-
ایمنیرسوبی کروماتین (Chromatin Immunoprecipitation یا ChIP) و گونههای مختلف آن مانند ChIP-on-chip و ChIP-Seq: این تکنیکها برای شناسایی نواحی خاصی از DNA که با پروتئینهای خاص مانند هیستونها یا فاکتورهای رونویسی برهمکنش دارند به کار میروند.
-
تکنیکهای نشانهگذاری فلورسنت (Fluorescent Labeling) برای بررسی ساختار و تغییرات اپیژنتیکی در سطح سلولی.
-
استفاده از آنزیمهای محدودکننده حساس به متیلاسیون برای تمایز بین DNA متیله شده و غیرمتیله.
-
تکنولوژی DamID (شناسایی DNA آدنین متیل ترانسفراز) که با اتصال پروتئینهای خاص به آدنین متیله شده، محلهای اتصال پروتئینهای تنظیمی را آشکار میکند.
-
تعیین توالی DNA با استفاده از بیسولفیت، که به شناسایی دقیق سیتوزینهای متیله شده کمک میکند.
افزون بر روشهای آزمایشگاهی، ابزارهای بیوانفورماتیکی نیز نقش کلیدی در تحلیل دادههای حاصل از این تکنیکها و درک الگوهای اپیژنتیکی ایفا میکنند.
اپیژنتیک مولکولی
تغییرات اپیژنتیکی، فعالیت ژنها را بدون ایجاد تغییر در توالی اصلی DNA تنظیم میکنند. در واقع، این تغییرات در سطح ریزساختاری DNA یا پروتئینهای مرتبط با کروماتین (از جمله هیستونها) رخ میدهند و منجر به فعال یا خاموش شدن ژنها میشوند.
این سازوکارها به سلولهای تمایز یافته در موجودات چندسلولی اجازه میدهند تنها ژنهایی را بیان کنند که برای عملکرد خاص آنها ضروری است. جالب آنکه، این تغییرات اپیژنتیکی در طی تقسیمات سلولی حفظ میشوند، هرچند که در اغلب موارد تنها در طول عمر همان فرد باقی میمانند.
با این حال، در برخی شرایط، این تغییرات میتوانند از طریق فرآیندی به نام وراثت اپیژنتیکی تراریخته (Transgenerational Epigenetic Inheritance) به نسلهای بعدی منتقل شوند. بهویژه، اگر یک ژن در اسپرم یا تخمک غیرفعال شود و این سلولها در فرآیند لقاح شرکت کنند، این تغییرات ممکن است به نسل بعدی منتقل گردند.
برخی از فرآیندهای کلیدی اپیژنتیکی عبارتاند از:
-
پاراموتاسیون
-
نشانهگذاری اپیژنتیکی
-
نقشپذیری ژنی (Genomic Imprinting)
-
خاموشی ژنی
-
غیرفعالسازی کروموزوم X
-
اثر موقعیت (Position Effect)
-
برنامهریزی مجدد متیلاسیون DNA
-
اثرات سلول مادری
-
تأثیرات تراتوژنها
-
تغییرات هیستونی و تشکیل هتروکروماتین
-
فرآیندهای دخیل در بروز و پیشرفت سرطان
آسیب DNA و نقش آن در اپیژنتیک
آسیبهای DNA میتوانند محرک تغییرات اپیژنتیکی باشند. این نوع آسیبها در بدن انسان بسیار رایجاند، بهطوریکه بهطور میانگین در هر سلول حدود ۶۰ هزار بار در روز رخ میدهند. با وجود اینکه سیستم ترمیم DNA اکثر این آسیبها را برطرف میکند، در محل ترمیم، تغییرات اپیژنتیکی پایدار میتوانند باقی بمانند.
بهطور خاص، شکستگی دو رشتهای DNA (Double-Strand Breaks) میتواند آغازگر خاموش شدن برنامهریزینشده ژن از طریق متیلاسیون DNA و تغییرات هیستونی باشد.
در این میان، آنزیم PARP1 (پلی ADP-ریبوز پلیمراز) و محصول آن یعنی پلی(ADP)-ریبوز (PAR)، در نواحی آسیبدیده تجمع مییابند. این تجمع موجب جذب و فعالسازی پروتئین ALC1 میشود که در بازسازی کروماتین و بازآرایی نوکلئوزوم نقش دارد.
نشان داده شده است که بازسازی نوکلئوزوم از این مسیر، میتواند منجر به خاموشی ژنهای ترمیمکننده DNA شود.
از سوی دیگر، مواد شیمیایی آسیبرسان به DNA مانند بنزن، هیدروکینون، استایرن، تتراکلریدکربن و تریکلرواتیلن، با فعالسازی مسیرهای استرس اکسیداتیو، باعث هیپومتیلاسیون DNA میشوند.
در مقابل، برخی ترکیبات غذایی مانند ایزوفلاونهای سویا باعث کاهش آسیب DNA شده و حتی فعالیت آنزیمهای ترمیمکننده DNA نظیر MGMT، MLH1 و p53 را افزایش میدهند. در مطالعهای، مصرف رژیم غذایی حاوی سویا به مدت سه هفته منجر به کاهش نشانگرهای استرس اکسیداتیو شد. همچنین، عصاره زغالاخته غنی از آنتوسیانین نیز باعث کاهش آسیب DNA تنها دو ساعت پس از مصرف گردید.
تغییرات کووالانسی کروماتین
تغییرات کووالانسی در کروماتین، به دو دسته کلی تقسیم میشوند:
-
تغییرات کووالانسی در DNA
مانند متیلاسیون سیتوزین (تبدیل سیتوزین به 5-متیل سیتوزین) و هیدروکسیمتیلاسیون. -
تغییرات کووالانسی در هیستونها
شامل استیلاسیون لیزین، متیلاسیون لیزین و آرژنین، فسفوریلاسیون سرین و ترئونین، افزایندهسازی لیزین (Ubiquitination)، و سومویلاسیون (SUMOylation).
این تغییرات در بسیاری از مکانیسمهای وراثت اپیژنتیکی نقش اساسی دارند و در مواردی، واژه اپیژنتیک به صورت مترادف با همین فرایندها به کار میرود. با این حال، باید توجه داشت که بازسازی کروماتین همیشه وراثتپذیر نیست و همه پدیدههای وراثتی اپیژنتیک الزاماً شامل بازسازی کروماتین نمیشوند.
فنوتیپ سلول یا فرد تا حد زیادی به الگوهای رونویسی ژنی بستگی دارد. تنظیم رونویسی میتواند از طریق بازسازی کروماتین انجام شود. کروماتین از DNA و پروتئینهای هیستونی تشکیل شده و تغییر در نحوه بستهبندی DNA بر روی هیستونها میتواند بیان ژن را دگرگون سازد.
بازسازی کروماتین از طریق دو مکانیسم اصلی صورت میگیرد:
۱. اصلاح پس از ترجمه اسیدهای آمینه هیستونی
پروتئینهای هیستونی از زنجیرههای اسیدآمینه ساخته شدهاند و اصلاحاتی مانند متیلاسیون یا استیلاسیون بر این زنجیرهها میتوانند شکل و عملکرد هیستونها را تغییر دهند. این تغییرات ممکن است در هنگام همانندسازی DNA به نوکلئوزومهای جدید منتقل شوند و بر رونویسی نسخههای جدید تأثیر بگذارند.
۲. افزودن گروههای متیل به DNA
متیلاسیون سیتوزین، بهویژه در جایگاههای CpG، یکی از مهمترین سازوکارهای اپیژنتیکی است. این متیلاسیون معمولاً با خاموشی ژنها در نواحی پروموتر و تقویتکننده همراه است. در مقابل، در برخی نواحی دیگر مانند مناطق داخلی ژنها (غیر از نقاط آغاز رونویسی)، متیلاسیون ممکن است افزایش بیان ژن را به همراه داشته باشد.
عوامل رونویسی به توالیهای خاصی در پروموتر ژنها متصل میشوند. اگر این توالیها دارای سیتوزینهای متیله شده باشند، حدود ۲۲٪ از فاکتورهای رونویسی نمیتوانند متصل شوند. علاوه بر این، سیتوزینهای متیله میتوانند پروتئینهای MBD (Methyl-CpG Binding Domain) را جذب کنند که در نهایت به خاموش شدن ژنها از طریق برهمکنش با کمپلکسهای بازسازی نوکلئوزوم و هیستون دیاستیلازها منجر میشود.
همچنین، آنزیمهای خانواده TET میتوانند سیتوزین متیله شده را اصلاح کنند. این اصلاحات بهطور گسترده در فرآیندهایی مانند یادگیری و حافظه در نورونها اتفاق میافتند.
وراثتپذیری اپیژنتیکی
مکانیسمهای وراثت تغییرات هیستونی هنوز بهطور کامل شناخته نشدهاند. با این حال، مکانیسمهای وراثت متیلاسیون DNA به خوبی مشخص شدهاند. در این فرآیند، آنزیمهایی مانند DNMT1 که بهطور اختصاصی به 5-متیل سیتوزین متصل میشوند، نقش کلیدی دارند.
هنگامیکه DNA پس از همانندسازی به صورت نیمهمتیله (Hemimethylated) در میآید، یعنی متیلاسیون تنها در یک رشته از DNA دو رشتهای وجود دارد، آنزیم DNMT1 با شناسایی این بخش، رشته مکمل را نیز متیله میکند. این فرآیند، پایداری و انتقال الگوهای متیلاسیون را در تقسیمات سلولی تضمین میکند.
اگرچه تغییرات هیستونی در سراسر ژنوم رخ میدهند، اما عمده این تغییرات بر روی انتهای آمینی هیستونها که به آنها «دمهای هیستونی» گفته میشود، متمرکز هستند. این دمها دچار مجموعهای متنوع از اصلاحات پسارویشی میشوند که شامل استیلاسیون، متیلاسیون، یوبیکوئیتیناسیون، فسفوریلاسیون، سومویلاسیون، ریبوسیلاسیون و سیترولیناسیون است. به عنوان نمونه، استیلاسیون لیزینهای K14 و K9 موجود در دم هیستون H3 توسط آنزیمهای هیستون استیلترانسفراز (HATs)، اغلب با رونویسی صحیح ژنها مرتبط است.
متیلاسیون DNA چیست؟
«متیلاسیون» (DNA Methylation) فرآیندی است که طی آن به طور مکرر، گروههای متیل به بازهای خاصی در توالی DNA متصل میشوند و این تغییر اپیژنتیکی به سرکوب بیان ژن و کاهش فعالیت عناصر قابل انتقال کمک میکند. یکی از مهمترین مکانهای متیلاسیون، سیتوزینهای موجود در توالیهای CpG هستند. 5-متیلسیتوزین، باز تغییریافته حاصل از این فرآیند، میتواند به طور خودبهخود دچار دگرگونی شده و با جایگزینی نیتروژن توسط اکسیژن، به تیمیدین تبدیل شود. این پدیده باعث میشود که جایگاههای CpG در ژنوم بهتدریج دچار جهش و کاهش شوند، به جز در «جزایر CpG» که اغلب در نواحی پروموتر ژنهای حیاتی قرار دارند و به صورت غیرمتیله باقی میمانند.
به این ترتیب، تغییرات اپیژنتیکی از طریق متیلاسیون DNA، این قابلیت را دارند که فرکانس جهشهای ژنتیکی پایدار را افزایش دهند. الگوهای متیلاسیون DNA در پاسخ به عوامل محیطی و با تعامل پیچیدهای از مکانیسمهای مولکولی تنظیم میشوند. حداقل سه نوع آنزیم متیلترانسفراز مستقل شامل DNMT1، DNMT3A و DNMT3B در این فرآیند نقش دارند. مطالعات نشان دادهاند که حذف هر یک از این آنزیمها در موش اثر کشنده دارد.
از میان این آنزیمها، DNMT1 فراوانترین متیلترانسفراز در سلولهای سوماتیک است. این آنزیم در محلهای همانندسازی DNA تجمع مییابد و ترجیح بالایی (۱۰ تا ۴۰ برابر) برای شناسایی و متیله کردن DNAهای «همیمتیله» (که فقط یک رشته آن متیله است) دارد. DNMT1 همچنین با آنتیژن هستهای سلول تکثیرشونده (PCNA) تعامل دارد و از طریق شناسایی DNA همیمتیله، الگوی متیلاسیون را به رشته جدید سنتز شده منتقل میکند. از این رو، این آنزیم به عنوان «متیلترانسفراز نگهدارنده» شناخته میشود.
عملکرد DNMT1 برای رشد مناسب جنین، فرآیند «ایمپرینتینگ» ژنها و غیرفعالسازی یکی از کروموزومهای X در جنس ماده، کاملاً ضروری است. به منظور تأکید بر تفاوت بین این نوع وراثت مولکولی و وراثت کلاسیک که مبتنی بر جفتسازی بازهای نیتروژنی در مدل واتسون–کریک است، اصطلاح «الگوی اپیژنتیکی» به کار گرفته میشود. این مفهوم نهتنها برای حفظ و انتقال حالتهای متیلاسیون DNA بهکار میرود، بلکه میتواند برای انتقال تغییرات اپیژنتیکی دیگر مانند تغییرات هیستونی یا حتی تغییرات ساختاری و سیتوپلاسمی نیز بهکار گرفته شود.
متیلاسیون هیستونها
هیستونهای H3 و H4 نیز میتوانند از طریق متیلاسیون تغییر یابند. این فرآیند توسط آنزیمهای هیستون لیزین متیلاز (KDM) انجام میشود. یکی از آنزیمهای مهم در این زمینه، آنزیمی با جایگاه فعال کاتالیتیکی به نام دامنه Jumonji یا JmjC است. JmjC برای عملکرد خود نیاز به چندین فاکتور دارد و میتواند از طریق هیدروکسیله کردن گروه متیل، آن را حذف کند. این آنزیمها قادرند لایههای مختلف متیلاسیون شامل مونومتیلاسیون، دیمتیلاسیون و تریمتیلاسیون را تنظیم کنند.
نواحی کروموزومی میتوانند حالتهای اپیژنتیکی پایدار و قابل وراثت اتخاذ کنند و در نتیجه، بیان ژن را بدون نیاز به تغییر در توالی DNA حفظ کنند. کنترل اپیژنتیکی معمولاً با تغییرات کووالانسی در جایگزینی هیستونها در ارتباط است. پایداری و قابلیت وراثت این نواحی زمانی بیشتر میشود که نوکلئوزومهای تغییر یافته، آنزیمهایی را به خدمت بگیرند که به نوبه خود، نوکلئوزومهای مجاور را به طور مشابه تغییر دهند. این چرخه بازخورد مثبت، نقش مهمی در تنظیم پایدار بیان ژن ایفا میکند.
نقش RNAهای کوچک در اپیژنتیک
تنظیم رونویسی مبتنی بر کروماتین میتواند با دخالت RNAهای کوچک مانند miRNAها یا siRNAها صورت گیرد. این RNAها قادرند از طریق مدولاسیون اپیژنتیکی پروموترهای هدف، بیان ژن را تعدیل کنند. در برخی موارد، یک ژن پس از فعال شدن، محصولاتی را تولید میکند که مستقیماً یا بهطور غیرمستقیم، موجب تداوم فعالیت همان ژن میشوند. برای مثال، فاکتورهای رونویسی Hnf4 و MyoD به ترتیب با تقویت رونویسی ژنهای خاص کبدی و عضلانی، از جمله خودشان، در حفظ فعالیت ژنی نقش دارند.
فرآیند سیگنالدهی RNA شامل جذب ترتیبی مجموعههایی از کمپلکسهای اصلاحکننده کروماتین و آنزیمهای متیلترانسفراز DNA به نواحی خاصی از ژنوم در طی تمایز و رشد است. سایر تغییرات اپیژنتیکی نیز از طریق شکلگیری فرمهای مختلف اتصال RNA یا ایجاد RNA دو رشتهای (RNAi) به وقوع میپیوندند.
سلولهای حاصل از تقسیم سلولی، در صورت فعال بودن یک ژن، این وضعیت را حتی در غیاب محرک اولیه حفظ میکنند. این ژنها معمولاً از طریق سیگنالهایی روشن یا خاموش میشوند، اما در برخی سیستمها مانند سینسیتیا یا در حضور اتصالات سلولی شکافدار، RNA میتواند مستقیماً به دیگر سلولها یا هستهها منتقل شود.
در مراحل اولیه رشد، مانند تخمکگذاری، مقدار قابل توجهی RNA و پروتئین از مادر به تخم منتقل میشود که نقش مهمی در ایجاد فنوتیپهای مادری ایفا میکند. در سوی دیگر، مقدار کمتری از RNA نیز از اسپرم پدر به تخم منتقل میشود. با این حال، یافتههای جدید نشان دادهاند که این اطلاعات اپیژنتیکی از طریق RNAهای اسپرم میتوانند موجب تغییرات قابل مشاهدهای در نسلهای بعد شوند.
میکرو RNA (miRNA)
miRNAها نوعی از RNAهای غیرکدکننده با طول 17 تا 25 نوکلئوتید هستند که طیف گستردهای از عملکردهای بیولوژیک را در گیاهان و جانوران تنظیم میکنند. تا سال 2013، حدود 2000 نوع miRNA در انسان شناسایی شده بود. هر miRNA میتواند حدود 100 تا 200 RNA پیامرسان (mRNA) را شناسایی و تنظیم کند. اکثر این تنظیمها با از بین بردن mRNAهای هدف صورت میگیرد، هرچند بخشی از آنها نیز در مرحله ترجمه و تولید پروتئین اثرگذار هستند.
تخمین زده میشود که حدود 60 درصد از ژنهای کدکننده پروتئین در انسان، توسط miRNAها تنظیم میشوند. بسیاری از miRNAها نیز خود تحت تأثیر تنظیمات اپیژنتیکی قرار دارند. تقریباً 50 درصد از ژنهای miRNA در نزدیکی جزایر CpG قرار دارند که ممکن است از طریق متیلاسیون سرکوب شوند. به طور معمول، جزایر CpG متیلهشده، بهشدت و بهشکل موروثی خاموش باقی میمانند. علاوه بر این، تنظیم برخی از miRNAها از طریق تغییرات اپیژنتیکی دیگر مانند تغییرات هیستونی نیز صورت میگیرد.
متیلاسیون RNA پیامرسان (mRNA)
در سال 2011 مشخص شد که متیلاسیون mRNA، به ویژه متیلاسیون باز آدنوزین در موقعیت N6 (N6-methyladenosine)، نقش مهمی در تعادل انرژی در بدن انسان دارد. ژن FTO که با چاقی مرتبط است، میتواند این متیلاسیون را از بین ببرد و بنابراین در فرآیندهای تنظیمی اپیژنتیکی mRNAها نقش دارد.
sRNA
sRNAها قطعات کوچک RNA (در حدود ۵۰ تا ۲۵۰ نوکلئوتید) با ساختاری پیچیده هستند که در باکتریها یافت میشوند. آنها در تنظیم بیان ژنها، از جمله ژنهای مرتبط با بیماریزایی، نقش مهمی ایفا میکنند و بهعنوان اهداف جدیدی برای مقابله با باکتریهای مقاوم به دارو در نظر گرفته میشوند. این مولکولها با اتصال به mRNAها و پروتئینهای خاص در پروکاریوتها، فعالیت خود را انجام میدهند.
تحلیلهای فیلوژنتیکی، مانند بررسی تعاملات sRNA–mRNA یا ویژگیهای اتصال به پروتئین، به منظور ایجاد پایگاههای داده جامع صورت میگیرد. همچنین، بر اساس اهداف sRNAها در ژنومهای میکروبی، نقشههای ژنی نیز ترسیم شدهاند.
وراثت ساختاری
در برخی ارگانیسمهای تکسلولی مانند Tetrahymena و Paramecium، تفاوتهای وراثتی در الگوی چینش مژکهای سطح سلول مشاهده شده است؛ این تفاوتها در حالی پدید میآیند که سلولها از نظر ژنتیکی یکساناند. الگوهای ساختاری حاصل، به سلولهای دختر نیز منتقل میشوند، گویی ساختارهای موجود نقش الگویی برای تشکیل ساختارهای جدید دارند. اگرچه مکانیسم دقیق این انتقال هنوز بهطور کامل مشخص نیست، اما شواهدی وجود دارد مبنی بر اینکه موجودات چندسلولی نیز از ساختارهای موجود برای شکلدهی ساختارهای نو بهره میبرند.
نقشپذیری ژنی چیست؟
نقشپذیری ژنی (Genomic Imprinting) نوعی پدیده اپیژنتیکی است که در آن بیان فنوتیپی ژن به والد اهداکننده آن بستگی دارد. در فرزندان هتروزیگوت، دریافت آلل از مادر یا پدر میتواند به بروز فنوتیپ متفاوتی منجر شود، در حالیکه در افراد هموزیگوت (aa یا AA) فنوتیپ مستقل از منبع آلل است. بنابراین، این نوع وراثت با قوانین مندل همخوانی ندارد. نقشپذیری ژنی ناشی از تغییراتی مانند متیلاسیون DNA، اصلاحات هیستونی و تداخل RNA است که بر ساختار کروماتین و دسترسی به ژن تأثیر میگذارند.
پریونها
پریونها، پروتئینهایی با ساختار عفونی هستند که برخلاف ساختار طبیعیشان، میتوانند به شکل نادرستی تا شوند و با القای همین ساختار به پروتئینهای طبیعی، آنها را نیز به فرم عفونی تبدیل کنند. این خاصیت باعث شده تا پریونها در دسته عوامل اپیژنتیکی نیز قرار گیرند، چرا که بدون تغییر در توالی DNA، تغییرات پایدار فنوتیپی ایجاد میکنند. در قارچها نیز پریونهایی شناسایی شدهاند که فنوتیپهای ناشی از آنها میتوانند به نسلهای بعدی منتقل شوند.
موقعیت نوکلئوزوم
در ژنوم یوکاریوتی، نوکلئوزومها بهصورت تصادفی توزیع نشدهاند، بلکه جایگاه آنها تعیینکننده میزان دسترسی DNA به فاکتورهای رونویسی است. این موقعیتها بسته به نوع بافت و وضعیت تمایزی سلول متفاوتاند و نقش کلیدی در بیان ژن دارند. در اسپرم، برخی نوکلئوزومها بهرغم جایگزینی عمده هیستونها با پروتامینها، حفظ میشوند. این موضوع بیانگر وراثت نسبی موقعیت نوکلئوزومهاست. مطالعات همچنین به ارتباط بین جایگاه نوکلئوزوم و تغییرات اپیژنتیکی مانند متیلاسیون DNA و هیدروکسیمتیلاسیون اشاره کردهاند.
ساختار سهبعدی ژنومی
پیکربندی سهبعدی ژنوم، عاملی پیچیده و پویاست که نقش اساسی در تنظیم عملکردهای هستهای همچون رونویسی، تکثیر و ترمیم DNA دارد. این ساختار فضایی، با شکلدهی به نحوه تعامل ژنها با یکدیگر و با فاکتورهای تنظیمی، بیان ژنها را در سطوح مختلف کنترل میکند.
آغازگر اپیژنتیک (Epigenetic Priming)
پرایمینگ اپیژنتیکی فرآیندی است که طی آن، نواحی خاصی از کروماتین از حالت بسته به حالت باز تغییر مییابند و امکان دسترسی عوامل تنظیمی را به DNA فراهم میکنند. این تغییرات معمولاً تحت تأثیر عوامل محیطی یا سیگنالهای سلولی خاص رخ میدهند و میتوانند اثرات بلندمدت بر بیان ژن در مراحل مختلف زندگی سلول داشته باشند. پرایمینگ اپیژنتیکی در علوم اعصاب (مثلاً در شکلگیری حافظه) و تحقیقات سرطان (برای فعالسازی ژنهای سرکوبگر تومور) کاربرد ویژهای دارد.
دوقلوها و اپیژنتیک
بررسی دوقلوهای همسان (تکتخمکی) بهدلیل داشتن ژنوم یکسان، مدلی مناسب برای مطالعه تأثیر محیط بر تغییرات اپیژنتیکی است. مطالعات نشان دادهاند که دوقلوهای جوانتر شباهت بیشتری در الگوهای متیلاسیون DNA و استیلاسیون هیستون دارند، اما این شباهت با افزایش سن کاهش مییابد؛ بهویژه در مواردی که دوقلوها محیطهای زندگی یا تاریخچه پزشکی متفاوتی داشتهاند.
این تفاوتها بهدلیل «رانش اپیژنتیکی» (Epigenetic Drift) ایجاد میشود؛ پدیدهای که طی آن، با افزایش سن، تغییرات تصادفی در الگوهای اپیژنتیکی رخ میدهد. این رانش میتواند اختلاف میان سن زیستی و سن تقویمی فرد ایجاد کند و در برخی موارد، بهعنوان نشانگرهای زیستی بیماریها پیش از ظهور علائم بالینی عمل کند.
مطالعات بزرگتر شامل بررسی صدها جفت دوقلو نشان دادهاند که شباهت اپیژنتیکی حتی در مراحل اولیه رشد، مانند تقسیم بلاستوسیست، میتواند بر فنوتیپ نهایی تأثیر بگذارد. این یافتهها اهمیت تأثیر محیط جنینی اولیه را در شکلگیری تفاوتهای اپیژنتیکی تقویت میکنند.
بیماریهای ژنتیکی و نقش اپیژنتیک
در برخی اختلالات مانند سندرم آنجلمن و سندرم پرادر-ویلی، نقشپذیری ژنی و اپیژنتیک نقش اصلی را ایفا میکنند. در این موارد، حذف یا غیرفعال شدن یک نسخه از ژن کافی است تا بیماری بروز کند، حتی اگر نسخه دوم سالم باشد؛ این در حالی است که در سایر بیماریهای ژنتیکی، معمولاً نیاز به غیرفعال شدن هر دو نسخه ژن است.
اپیژنتیک و سلامت
اپیژنتیک نقش گستردهای در حوزه پزشکی دارد و با فرایندهایی مانند پیری، رشد، بروز بیماریهای قلبی، روانی، سرطان و بسیاری اختلالات دیگر در ارتباط است. برخی پژوهشگران معتقدند که در بعضی بیماریها، نقش اپیژنتیک حتی از ژنتیک بنیادیتر است.
تأثیر دارو بر اپیژنتیک
برخی داروها میتوانند از طریق مکانیسمهای اپیژنتیکی، بر بیان ژنها تأثیر بگذارند. بهعنوان مثال، آنتیبیوتیکهای بتا لاکتام میتوانند بر عملکرد گیرندههای گلوتامات اثر بگذارند، یا سیکلوسپورین ممکن است برخی فاکتورهای رونویسی را تحت تأثیر قرار دهد. همچنین، لیتیوم و سوءمصرف مواد مخدر از جمله عوامل دیگری هستند که از طریق تغییر اپیژنتیکی، بهویژه در بیان ژنهای خاص، اثرات پایداری در بدن ایجاد میکنند.
اپیژنتیک مطالعه تغییرات قابل ارث در بیان ژن یا فنوتیپ سلولی است که بدون تغییر در توالی اصلی DNA رخ میدهد. این تغییرات میتوانند نحوه فعال یا غیرفعال شدن ژنها را تنظیم کنند و نقش بسیار مهمی در رشد، تمایز سلولی و بروز بیماریها ایفا کنند. برخلاف جهشهای ژنتیکی که باعث تغییر کد DNA میشوند، تغییرات اپیژنتیکی از طریق تغییرات شیمیایی روی DNA یا ساختار کروماتین بر فعالیت ژنها تأثیر میگذارند، که این تغییرات اغلب در پاسخ به عوامل محیطی ایجاد میشوند.
اصطلاح «اپیژنتیک» برای اولین بار توسط کانراد وادینگتون در دهه ۱۹۴۰ مطرح شد تا تعامل بین ژنها و محصولات آنها که باعث شکلگیری فنوتیپ میشود را توصیف کند. از آن زمان، این حوزه به طور چشمگیری گسترش یافته و مکانیزمهای پیچیدهای مانند متیلاسیون DNA، تغییرات روی هیستونها، بازآرایی کروماتین و RNAهای غیرکدکننده را آشکار ساخته است.
درک اپیژنتیک تحول بزرگی در تحقیقات زیستی و پزشکی ایجاد کرده است. این مفهوم توضیح میدهد که چرا دوقلوهای همسان با یک ژنوم میتوانند ویژگیهای متفاوتی داشته باشند، چگونه مواجهه با عوامل محیطی میتواند اثرات ماندگاری بر بیان ژنها داشته باشد، و چگونه بیماریهایی مانند سرطان، اختلالات عصبی و مشکلات متابولیکی میتوانند از طریق اختلال در اپیژنتیک ایجاد شوند.
در این مقاله، ما به بررسی مکانیزمهای اساسی اپیژنتیک، ابزارهای مطالعه آن و کاربردهای گستردهاش در سلامت، کشاورزی و بیوتکنولوژی خواهیم پرداخت.
فهرست مطالب
-
چشمانداز تاریخی اپیژنتیک
-
مفاهیم و تعاریف پایه
-
مکانیزمهای کلیدی اپیژنتیک
-
متیلاسیون DNA
-
تغییرات روی هیستونها
-
بازآرایی کروماتین
-
RNAهای غیرکدکننده
-
-
تنظیم اپیژنتیکی بیان ژن
-
اپیژنتیک در رشد و تمایز
-
تأثیرات محیطی بر اپیژنتیک
-
اپیژنتیک و بیماریها
-
سرطان
-
اختلالات عصبی
-
بیماریهای متابولیک
-
-
وراثت اپیژنتیکی و اثرات چندنسلی
-
تکنیکهای مطالعه اپیژنتیک
-
کاربردهای درمانی اپیژنتیک
-
داروهای اپیژنتیکی
-
پزشکی شخصی
-
-
اپیژنتیک در کشاورزی و بیوتکنولوژی
-
جهتگیریها و چالشهای آینده
-
نتیجهگیری
1. چشمانداز تاریخی اپیژنتیک
مفهوم اپیژنتیک از زیستشناسی توسعهای اولیه به درک مولکولی مدرن تنظیم ژنها تکامل یافته است.
-
کانراد وادینگتون (دهه ۱۹۴۰): اصطلاح «اپیژنتیک» را برای توصیف نحوه تعامل ژنها با محیطشان جهت تولید فنوتیپ به کار برد. این مفهوم به صورت تصویری به شکل «چشمانداز اپیژنتیک» ارائه شد.
-
دهههای ۱۹۷۰–۱۹۸۰: کشف متیلاسیون DNA و نقش آن در تنظیم ژنها. مطالعات نشان دادند که متیلاسیون میتواند باعث خاموشی ژنها شود.
-
دهه ۱۹۹۰: شناسایی تغییرات روی هیستونها و مطرح شدن فرضیه «کد هیستون»، که بیان میکند دنبالههای هیستونی حامل نشانههای شیمیاییای هستند که ساختار کروماتین و فعالیت ژن را تنظیم میکنند.
-
دهه ۲۰۰۰: آغاز پروژه «اپیژنوم انسانی» برای نقشهبرداری الگوهای متیلاسیون DNA در سراسر ژنوم. پیشرفت در تکنولوژی توالییابی شتاب قابل توجهی به تحقیقات اپیژنتیکی بخشید.
-
امروزه: اپیژنتیک به عنوان یک لایه اساسی در تنظیم ژنوم شناخته شده است که در تقریباً تمام زمینههای زیستشناسی و پزشکی اهمیت دارد.
2. مفاهیم و تعاریف پایه
-
اپیژنوم: مجموعه کامل تغییرات اپیژنتیکی روی ماده ژنتیکی یک سلول.
-
کروماتین: ترکیب DNA و پروتئینها (عمدتاً هیستونها) که DNA را در هسته سلول بستهبندی میکند.
-
بیان ژن: فرآیندی که در آن اطلاعات یک ژن برای ساخت محصولات عملکردی مانند پروتئینها استفاده میشود.
-
نشانههای اپیژنتیکی: تغییرات شیمیایی روی DNA یا هیستونها که بدون تغییر توالی DNA، بر بیان ژن تأثیر میگذارند.
3. مکانیزمهای کلیدی اپیژنتیک
3.1 متیلاسیون DNA
-
تعریف: اضافه شدن یک گروه متیل (CH3) به کربن ۵ سیتوزین، عمدتاً در جایگاههای CpG (جفت باز سیتوزین-گوانین).
-
آنزیمها: DNA متیلترانسفرازها (DNMTs) از جمله DNMT1، DNMT3A و DNMT3B مسئول این فرآیند هستند.
-
وظیفه: معمولاً باعث خاموشی ژنها میشود؛ این کار از طریق جلوگیری از اتصال فاکتورهای رونویسی یا جذب پروتئینهایی که کروماتین را فشرده میکنند، انجام میشود.
-
نقش: متیلاسیون در پدیدههایی مانند ایمپرینتینگ ژنومی، غیرفعالسازی کروموزوم X و سرکوب عناصر متحرک نقش حیاتی دارد.
-
تنظیم دینامیک: الگوهای متیلاسیون DNA میتوانند به صورت فعال توسط آنزیمهای TET که باعث اکسیداسیون متیلسیتوزین میشوند، حذف گردند.
3.2 تغییرات روی هیستونها
-
انواع: استیلاسیون (آستیلدار شدن)، متیلاسیون، فسفریلاسیون، یوبیکوئیتیناسیون، سامویلاسیون روی دنبالههای هیستون.
-
آنزیمها: شامل هیستون استیلترانسفرازها (HATs)، هیستون داستیلازها (HDACs)، متیلترانسفرازها و دمتیلآزها.
-
تأثیرات: استیلاسیون معمولاً با فعالسازی ژن همراه است زیرا باعث باز شدن ساختار کروماتین میشود؛ اثرات متیلاسیون بسته به جایگاه و نوع آن متفاوت است.
-
فرضیه کد هیستون: الگوی تغییرات روی هیستونها یک کد است که وضعیت کروماتین و فعالیت ژن را تعیین میکند.
3.3 بازآرایی کروماتین
-
مجموعههای وابسته به ATP مانند SWI/SNF موقعیت یا حذف نوکلئوزومها را تغییر میدهند تا دسترسی به DNA تنظیم شود.
-
هدف: تسهیل یا ممانعت از اتصال ماشینآلات رونویسی، ترمیم DNA و رونویسی.
3.4 RNAهای غیرکدکننده
-
انواع: شامل microRNAs (miRNAs)، RNAهای بلند غیرکدکننده (lncRNAs) و RNAهای کوچک مداخلهگر (siRNAs).
-
وظایف: تنظیم بیان ژن پس از رونویسی یا جذب عوامل اپیژنتیکی به مناطق خاص ژنومی.
4. تنظیم اپیژنتیکی بیان ژن
بیان ژن فرآیندی است که طی آن اطلاعات ژنتیکی به محصولات عملکردی مانند پروتئینها ترجمه میشود. تنظیم اپیژنتیکی نقش مهمی در کنترل این فرآیند دارد و میتواند ژنها را در زمان و مکانهای خاص فعال یا خاموش کند.
4.1 نقش متیلاسیون DNA در تنظیم بیان ژن
-
متیلاسیون در نواحی پروموتر ژنها معمولاً با سرکوب بیان آنها مرتبط است.
-
متیلاسیون باعث جذب پروتئینهای مهاری مانند MBD (Methyl-CpG binding domain proteins) میشود که کروماتین را به فرم فشرده تغییر میدهند و از دسترسی عوامل رونویسی به DNA جلوگیری میکنند.
-
در نواحی داخل ژن (ژن بادی)، متیلاسیون میتواند نقشهای پیچیدهتری داشته باشد، مانند تنظیم برش RNA یا جلوگیری از شروع رونویسی در نقاط غیرمجاز.
-
4.2 تغییرات روی هیستون و بیان ژن
-
هیستونهایی که با استیلاسیون همراه هستند، معمولاً نشانگر مناطق فعال ژنی هستند. این تغییر باعث باز شدن کروماتین و دسترسی بهتر فاکتورهای رونویسی میشود.
-
متیلاسیون هیستونها میتواند هم باعث فعال شدن و هم سرکوب ژنها شود، بسته به اینکه کدام اسید آمینه و کدام نوع متیلاسیون انجام شود. به عنوان مثال:
-
متیلاسیون H3K4 (هیستون H3، لیزین 4) معمولاً با فعال بودن ژن مرتبط است.
-
متیلاسیون H3K27 معمولاً با خاموشی ژن همراه است.
-
-
4.3 بازآرایی کروماتین و بیان ژن
-
کمپلکسهای بازآرایی کروماتین مانند SWI/SNF میتوانند موقعیت نوکلئوزومها را تغییر دهند و به این ترتیب مناطق ژنی را باز یا بسته کنند.
-
این تغییرات ساختاری، بهخصوص در نواحی پروموتر و انهانسر، دسترسی فاکتورهای رونویسی را تسهیل یا محدود میکنند.
-
4.4 RNAهای غیرکدکننده و تنظیم بیان ژن
-
miRNAها پس از تولید، به mRNAهای هدف متصل میشوند و باعث تجزیه آنها یا جلوگیری از ترجمه میشوند.
-
برخی از lncRNAها میتوانند به کروماتین متصل شده و آنزیمهای اپیژنتیکی را به محل خاصی هدایت کنند تا بیان ژن را تغییر دهند.
5. اپیژنتیک در رشد و تمایز سلولی
رشد و تمایز سلولی فرایندهایی هستند که طی آن سلولهای اولیه یا سلولهای بنیادی به سلولهای تخصصی با عملکردهای خاص تبدیل میشوند. این فرآیندها توسط تنظیم دقیق بیان ژن کنترل میشوند و اپیژنتیک نقش کلیدی در این تنظیم ایفا میکند.
5.1 نقش اپیژنتیک در جنینزایی (Embrogenesis)
-
در اوایل جنینزایی، سلولها تقریباً توانایی تمایز به همه نوع سلول را دارند (تکتوانی).
-
به مرور، الگوهای متیلاسیون DNA و تغییرات هیستونی تغییر میکند و باعث فعال یا خاموش شدن گروههای ژنی خاص میشود.
-
این تغییرات اپیژنتیکی مسیر تمایز سلولی را هدایت میکنند، به گونهای که سلولها به تدریج توانایی تبدیل شدن به انواع مختلف بافتها و اندامها را پیدا میکنند.
5.2 تمایز سلولی و تثبیت هویت سلولی
-
پس از تمایز، سلولها به یک وضعیت نسبتاً پایدار اپیژنتیکی میرسند که هویت و عملکرد خاص آنها را حفظ میکند.
-
این تثبیت با الگوهای ماندگار متیلاسیون DNA و نشانههای هیستونی مشخص اتفاق میافتد.
-
به عنوان مثال، سلولهای عصبی دارای الگوهای خاصی از هیستوناستیلاسیون و متیلاسیون هستند که با سلولهای عضلانی متفاوت است.
5.3 ایمپرینتینگ ژنتیکی (Genomic Imprinting)
-
ایمپرینتینگ یک پدیده اپیژنتیکی است که در آن تنها یکی از دو آلل (پدر یا مادر) یک ژن بیان میشود، در حالی که آلل دیگر خاموش است.
-
این پدیده از طریق متیلاسیون انتخابی DNA و تغییرات روی هیستون تنظیم میشود.
-
مثال: ژن IGF2 که تنها آلل پدری آن فعال است. اختلال در ایمپرینتینگ میتواند منجر به بیماریهایی مثل سندرم پرادر-ویلی شود.
5.4 غیرفعالسازی کروموزوم X
-
در سلولهای ماده، برای جلوگیری از اضافه بودن بیان ژنهای کروموزوم X، یکی از دو کروموزوم X به صورت اپیژنتیکی خاموش میشود.
-
این فرآیند شامل متیلاسیون DNA، تغییرات هیستونی و RNA غیرکدکننده XIST است که کروموزوم X را به شکل فشرده در میآورد و از بیان ژنها جلوگیری میکند.
-
این مکانیسم اطمینان میدهد که سلولهای ماده مانند سلولهای نر فقط یک نسخه فعال از ژنهای کروموزوم X دارند.
5.5 نقش RNAهای غیرکدکننده در تمایز
-
برخی lncRNAها به تنظیم فرآیند تمایز کمک میکنند، مثلاً با هدایت آنزیمهای اپیژنتیکی به ژنهای خاص.
-
miRNAها نیز میتوانند بیان ژنهای مرتبط با تمایز را تنظیم کنند.
6. تاثیر عوامل محیطی بر اپیژنتیک
اپیژنتیک به عنوان پلی بین ژنها و محیط عمل میکند. تغییرات اپیژنتیکی میتوانند تحت تأثیر عوامل محیطی مختلف قرار بگیرند و به این ترتیب، محیط بیرونی میتواند به صورت مستقیم یا غیرمستقیم بر بیان ژنها و سلامت فرد تاثیرگذار باشد.
6.1 تغذیه و رژیم غذایی
-
مواد غذایی مختلف میتوانند به عنوان منابع گروههای متیل (مثل فولیک اسید، ویتامین B12، کولین) عمل کنند که برای متیلاسیون DNA ضروری هستند.
-
تغییر در رژیم غذایی میتواند الگوهای متیلاسیون را تغییر دهد و در نتیجه بر رشد، سلامت و حتی خطر بیماریهای مزمن تاثیر بگذارد.
-
مثال: پژوهشهای انجام شده روی موشها نشان دادهاند که کمبود فولیک اسید در دوران بارداری میتواند باعث تغییرات اپیژنتیکی شود که رشد جنین را تحت تاثیر قرار میدهد.
6.2 سموم و آلودگیها
-
قرار گرفتن در معرض مواد شیمیایی مضر مانند دود سیگار، آفتکشها، فلزات سنگین و آلودگیهای هوا میتواند تغییرات اپیژنتیکی ایجاد کند.
-
این تغییرات ممکن است منجر به اختلال در بیان ژنها و افزایش خطر ابتلا به بیماریهایی مانند سرطان، بیماریهای تنفسی و اختلالات عصبی شوند.
-
مثال: مواجهه با دود سیگار باعث افزایش متیلاسیون ژنهایی میشود که در سرطان ریه نقش دارند.
6.3 استرس و رفتار
-
استرس مزمن روانی و شرایط زندگی ناسالم میتواند منجر به تغییرات اپیژنتیکی در مغز شود.
-
این تغییرات میتوانند بر تنظیم هورمونهای استرس و عملکرد نورونها تاثیر گذاشته و در ایجاد اختلالات روانی مانند افسردگی و اضطراب نقش داشته باشند.
-
مثال: مطالعات روی حیوانات نشان دادهاند که کمبود مراقبت مادرانه منجر به تغییرات در متیلاسیون ژنهای مرتبط با پاسخ به استرس میشود.
6.4 فعالیت بدنی و سبک زندگی
-
ورزش و فعالیت بدنی منظم میتواند الگوهای اپیژنتیکی را تغییر دهد و به بهبود سلامت متابولیک، عملکرد قلبی و مغزی کمک کند.
-
سبک زندگی سالم با کاهش تنش اکسیداتیو و التهاب مزمن، تاثیرات مثبت بر اپیژنتیک دارد.
-
مثال: ورزش منظم باعث افزایش استیلاسیون هیستونهایی میشود که ژنهای محافظتکننده از سلول را فعال میکنند.
7. اپیژنتیک و بیماریها
اپیژنتیک نقش بسیار مهمی در ایجاد و پیشرفت بسیاری از بیماریها دارد. تغییرات اپیژنتیکی میتوانند باعث تنظیم نادرست بیان ژنها شوند که در نهایت منجر به بروز بیماریهای مختلفی از جمله سرطانها، اختلالات عصبی و بیماریهای متابولیک میشود. در این بخش به مهمترین بیماریهایی که ارتباط قوی با اپیژنتیک دارند، میپردازیم.
7.1 سرطان
-
متیلاسیون غیرطبیعی DNA در سرطانها بسیار رایج است. معمولاً مناطق تنظیمی ژنهای سرکوبگر تومور دچار هایپرمتیلاسیون (افزایش بیش از حد متیلاسیون) میشوند که باعث خاموشی این ژنها میشود.
-
برعکس، مناطق دیگری از ژنوم ممکن است دچار هیپومتیلاسیون (کاهش متیلاسیون) شوند که منجر به فعال شدن ژنهای سرطانزا میگردد.
-
تغییرات در هیستونها و RNAهای غیرکدکننده نیز در تنظیم بیان ژنهای سرطان نقش دارند.
-
مثال: در سرطان سینه، متیلاسیون بیش از حد ژن BRCA1 باعث کاهش بیان این ژن و افزایش خطر سرطان میشود.
7.2 اختلالات عصبی
-
اپیژنتیک در رشد و عملکرد مغز بسیار حیاتی است. اختلالات اپیژنتیکی میتواند باعث بیماریهای عصبی و روانی شود.
-
بیماریهایی مانند اسکیزوفرنی، افسردگی، بیماری آلزایمر و بیماری هانتینگتون با تغییرات در الگوهای اپیژنتیکی مرتبط هستند.
-
مثال: در بیماری آلزایمر، تغییرات در متیلاسیون و استیلاسیون هیستونها باعث تغییر بیان ژنهای مرتبط با نورونها و التهاب مغزی میشود.
7.3 بیماریهای متابولیک
-
تغییرات اپیژنتیکی در ژنهایی که در متابولیسم گلوکز، لیپید و انرژی نقش دارند، میتواند منجر به بیماریهایی مانند دیابت نوع 2 و چاقی شود.
-
عوامل محیطی مانند رژیم غذایی ناسالم میتوانند این تغییرات را ایجاد کنند.
-
مثال: متیلاسیون غیرطبیعی ژن PGC-1α که در متابولیسم انرژی نقش دارد، با دیابت نوع 2 مرتبط است.
8. وراثت اپیژنتیکی و تأثیرات بین نسلی
وراثت اپیژنتیکی به انتقال تغییرات اپیژنتیکی از یک نسل به نسل بعد بدون تغییر در توالی DNA گفته میشود. برخلاف ژنهای معمولی که از طریق توالی DNA منتقل میشوند، تغییرات اپیژنتیکی میتوانند به نسلهای بعدی منتقل شوند و بر بیان ژنها و ویژگیهای فنوتیپی تأثیر بگذارند.
8.1 وراثت اپیژنتیکی بین نسلی
-
برخی از نشانههای اپیژنتیکی مانند الگوهای متیلاسیون DNA و اصلاحات هیستونی میتوانند در سلولهای زایا (گامتها) حفظ شوند و به فرزندان منتقل گردند.
-
این وراثت باعث میشود که اثرات محیطی (مثل تغذیه یا استرس) که بر والدین تأثیر گذاشتهاند، بتواند نسل بعد را نیز تحت تأثیر قرار دهد.
-
مثال: مطالعههای روی موشها نشان دادهاند که رژیم غذایی فقیر یا استرس در والدین میتواند باعث تغییرات اپیژنتیکی در فرزندان و حتی نوهها شود.
8.2 بازبرنامهریزی اپیژنتیکی (Epigenetic Reprogramming)
-
در دورههای مختلف رشد (مثل پیش از لقاح و در سلولهای بنیادی جنینی)، بیشتر نشانههای اپیژنتیکی پاکسازی و بازتنظیم میشوند تا ژنوم آماده شود.
-
این بازبرنامهریزی باعث میشود که اکثر نشانههای اپیژنتیکی که از والدین میآیند از بین بروند، اما برخی نشانهها (مانند ژنهای "imprinted") میتوانند از این پاکسازی فرار کنند و حفظ شوند.
8.3 حافظه اپیژنتیکی (Epigenetic Memory)
-
برخی سلولها میتوانند نشانههای اپیژنتیکی را حفظ کرده و به سلولهای دختر منتقل کنند، که این امر به آنها کمک میکند تا هویت سلولی و برنامه عملکردی خود را حفظ کنند.
-
مثال: سلولهای ایمنی که پس از یک عفونت، حافظه اپیژنتیکی ایجاد میکنند تا پاسخ سریعتر و مؤثرتری در مواجهه مجدد با عامل بیماریزا داشته باشند.
9. ابزارها و تکنیکهای مطالعه اپیژنتیک
برای درک دقیق مکانیزمهای اپیژنتیکی و نقش آنها در تنظیم ژنها، دانشمندان از تکنیکهای متنوعی استفاده میکنند که امکان شناسایی و تحلیل تغییرات اپیژنتیکی در سطح مولکولی را فراهم میکنند. در این بخش، مهمترین روشها و ابزارهای پژوهشی اپیژنتیک را بررسی میکنیم.
9.1 توالییابی بایسولفیت (Bisulfite Sequencing)
-
هدف: شناسایی و نقشهبرداری دقیق متیلاسیون DNA.
-
روش کار: در این روش، DNA با سدیم بایسولفیت تیمار میشود که باعث تبدیل سیتوزینهای غیرمتیله به اوراسیل میشود، در حالی که سیتوزینهای متیله دستنخورده باقی میمانند. سپس DNA تیمار شده توالییابی میشود و با مقایسه آن با توالی اصلی، محلهای متیلاسیون مشخص میشوند.
-
کاربرد: این روش دقیقترین و استاندارد طلایی برای مطالعه متیلاسیون DNA است و در تحقیقات بیماریها، توسعه دارو و اپیژنتیک تک سلولی کاربرد دارد.
9.2 توالییابی ایمنیرسوب کروماتین (ChIP-Seq)
-
هدف: تعیین مکانهای اتصال پروتئینهای خاص به DNA، مانند هیستونهای اصلاح شده یا فاکتورهای رونویسی.
-
روش کار: ابتدا پروتئینهای متصل به DNA در سلولها تثبیت (Crosslink) میشوند. سپس DNA به قطعات کوچک شکسته میشود و با استفاده از آنتیبادیهای خاص پروتئین مورد نظر، این بخشها جدا میشوند (ایمنیرسوب). نهایتاً این DNA جدا شده توالییابی میشود تا محلهای اتصال پروتئینها مشخص گردد.
-
کاربرد: شناسایی الگوهای اصلاح هیستون، فاکتورهای رونویسی و مکانهای فعال یا غیرفعال ژنها.
9.3 توالییابی دسترسی کروماتین (ATAC-Seq)
-
هدف: شناسایی مناطق باز و در دسترس کروماتین که امکان اتصال فاکتورهای رونویسی را دارند.
-
روش کار: آنزیم ترانسپوزاز به DNA نفوذ میکند و بخشهای باز کروماتین را برش میدهد و نشانهگذاری میکند. سپس این بخشها توالییابی میشوند.
-
کاربرد: تعیین ساختار کروماتین و مناطق فعال ژنی، مطالعه دینامیک کروماتین در شرایط مختلف.
9.4 توالییابی RNA و پروفایلینگ miRNA (RNA-Seq)
-
هدف: تحلیل بیان ژنها و RNAهای غیرکدکننده مانند miRNAها.
-
روش کار: RNA استخراج شده و تبدیل به cDNA میشود، سپس توالییابی میشود. دادهها برای تعیین میزان بیان ژنها و RNAهای کوچک پردازش میشوند.
-
کاربرد: بررسی تأثیرات اپیژنتیکی بر بیان ژن، شناسایی RNAهای تنظیمکننده اپیژنتیکی.
9.5 ویرایش اپیژنتیکی با CRISPR (CRISPR-based Epigenetic Editing)
-
هدف: ایجاد تغییرات اپیژنتیکی هدفمند بدون تغییر در توالی DNA.
-
روش کار: استفاده از سیستم CRISPR-Cas9 غیرکاتالیزور (dCas9) متصل به آنزیمهای اصلاحکننده اپیژنتیکی (مثل متیلازها یا استیل ترانسفرازها) برای هدفگیری دقیق مناطق خاص ژنومی و تغییر نشانههای اپیژنتیکی.
-
کاربرد: مطالعه عملکرد ژنها، درمان بیماریهای ناشی از اختلالات اپیژنتیکی، توسعه درمانهای ژنتیکی پیشرفته.
10. کاربردهای اپیژنتیک
اپیژنتیک با درک چگونگی تنظیم بیان ژنها بدون تغییر در توالی DNA، دریچههای نوینی را در علوم زیستی و پزشکی باز کرده است. کاربردهای گسترده و متنوعی دارد که در این بخش به مهمترین آنها میپردازیم.
10.1 پزشکی دقیق (Precision Medicine)
-
تعریف: پزشکی دقیق به معنای طراحی درمانها و داروها بر اساس ویژگیهای ژنتیکی و اپیژنتیکی هر فرد است.
-
نقش اپیژنتیک: مطالعه الگوهای اپیژنتیکی میتواند کمک کند تا حساسیت بیماران به داروها مشخص شود، پیشآگهی بیماریها بهتر پیشبینی شود و درمانهای هدفمندتر و مؤثرتری توسعه یابد.
-
مثال: در سرطان، پروفایل متیلاسیون DNA و تغییرات هیستونی میتواند نوع سرطان و پاسخ به داروها را مشخص کند.
10.2 بیومارکرهای اپیژنتیکی (Epigenetic Biomarkers)
-
تعریف: نشانگرهای مولکولی که بر اساس تغییرات اپیژنتیکی شناسایی میشوند و برای تشخیص، پیشآگهی و پیگیری بیماریها کاربرد دارند.
-
کاربردها: تشخیص زودهنگام سرطان، ارزیابی پاسخ به درمان، و تعیین خطر ابتلا به بیماریهای مزمن.
-
مثال: متیلاسیون ژن MLH1 در سرطان کولورکتال به عنوان بیومارکر مهم استفاده میشود.
10.3 هدفهای درمانی (Therapeutic Targets)
-
داروهای اپیژنتیکی: داروهایی که بر آنزیمهای تغییر دهنده اپیژنتیک (مثل DNMTها و HDACها) تأثیر میگذارند.
-
کاربرد: درمان سرطانها، اختلالات عصبی، بیماریهای التهابی و دیگر بیماریها.
-
مثال: داروهای مهارکننده HDAC در درمان لنفوم و برخی سرطانها استفاده میشوند.
10.4 کشاورزی و بهبود محصولات زراعی
-
تعریف: استفاده از دانش اپیژنتیک برای افزایش مقاومت گیاهان به شرایط محیطی، بهبود کیفیت محصولات و افزایش بهرهوری.
-
روشها: تنظیم اپیژنتیکی ژنهای مقاومت به خشکی، شوری، آفات و بیماریها.
-
مثال: گیاهانی که از طریق اپیژنتیک بهبود یافتهاند، مقاومت بیشتری به تنشهای محیطی نشان میدهند بدون تغییر در DNA اصلی.
10.5 اپیژنتیک در تکامل و سازگاری
-
نقش: اپیژنتیک میتواند پاسخهای سریع به تغییرات محیطی ایجاد کند و به عنوان مکانیسمی برای سازگاری و تکامل غیرژنتیکی عمل کند.
-
مثال: تغییرات اپیژنتیکی که در نسلهای متوالی منتقل میشوند، باعث تطبیق سریعتر ارگانیسمها با محیط میشوند.