کلونینگ چیست
فهرست مطالب:
-
همسانهسازی چیست؟
-
همسانهسازی DNA
-
اهداف همسانهسازی DNA
-
روشهای همسانهسازی DNA
-
ترانسفورم کردن – جذب DNA توسط سلولهای باکتری
-
تهیه سلولهای باکتریایی مستعد
-
انتخاب سلولهای ترانسفورم شده
-
شناسایی نوترکیبها
-
انتخاب نوترکیبها با غیرفعالسازی درجی ژن مقاومت به آنتیبیوتیک در ناقل pBR322
-
انتخاب نوترکیبها با غیرفعالسازی درجی ژن lacZ
-
ترانسفورم کردن سلولهای غیرباکتریایی
-
ترانسفورم کردن سلولهای منفرد
-
واکنش زنجیرهای پلیمراز (PCR)
کلونینگ (شبیهسازی): مفهومی جامع و عمیق
کلونینگ اصطلاحی است که تصاویری از دنیای داستانهای علمی-تخیلی تا دستاوردهای پیشگامانه پزشکی را در ذهن تداعی میکند. با وجود اینکه این واژه در گفتمان عمومی بسیار مطرح شده است، مفهوم علمی کلونینگ چندوجهی است و شامل روشها، اهداف و پرسشهای اخلاقی متنوعی میشود. در ذات خود، کلونینگ به فرآیند تولید نسخههای ژنتیکی یکسان از یک موجود زنده—چه ژن، سلول، بافت یا کل یک ارگانیسم—اشاره دارد. این مقاله به صورت عمیق به علم کلونینگ میپردازد و تاریخچه، مکانیزمها، انواع، کاربردها، چالشهای اخلاقی و چشماندازهای آینده آن را بررسی میکند.
تعریف کلونینگ: اصول پایه
کلونینگ در گستردهترین معنی خود به معنای تولید نسخهای دقیق و ژنتیکی مشابه از یک موجود یا ماده زیستی است. این واژه از کلمه یونانی "klon" به معنی "شاخه" یا "جوانه" گرفته شده که بیانگر ایدهی رشد یک گیاه جدید از یک قلمه است. از نظر علمی، کلونینگ شامل ساخت نسخههایی است که توالی DNA یکسانی با نمونه اولیه دارند.
باید به این نکته توجه کرد که کلونینگ یک پدیده مصنوعی یا غیرطبیعی نیست. بسیاری از موجودات به طور طبیعی در هنگام تولیدمثل خود را کلون میکنند. برای مثال، باکتریها به صورت غیرجنسی و از طریق تقسیم دوتایی تولید مثل میکنند که نتیجه آن سلولهای دختر با هویت ژنتیکی یکسان است. همچنین بسیاری از گیاهان از طریق شاخههای رونده، غدهها یا قلمهها تکثیر مییابند که موجب تولید فرزندان ژنتیکی یکسان میشود.
با این حال، در زیستشناسی مدرن، کلونینگ معمولاً به فرآیندهای کنترلشده آزمایشگاهی یا کشاورزی اشاره دارد که هدف آن تولید نسخههای ژنتیکی برای تحقیقات، درمان یا کاربردهای کشاورزی است.
پسزمینه تاریخی
سفر کلونینگ از اوایل قرن بیستم و با پیشرفتهای زیستشناسی رشد و ژنتیک آغاز شد. آزمایشهای اولیه روی دوزیستان نشان داد که سلولهای تمایز یافته (متخصص شده) میتوانند تحت شرایط مناسب مجدداً برنامهریزی شوند تا به یک ارگانیسم کامل تبدیل شوند.
یک نقطه عطف مهم در سال ۱۹۹۶ رخ داد، زمانی که دانشمندان اسکاتلندی، ایان ویلموت و کیت کمپبل موفق به کلون کردن گوسفند دولی شدند، اولین پستانداری که از سلولهای سوماتیک بالغ کلون شد. این دستاورد به طور قطعی نشان داد که یک سلول بالغ تمایز یافته میتواند مجدداً برنامهریزی شود تا کل یک ارگانیسم را تولید کند و باورهای پیشین درباره تمایز سلولی و پایداری ژنومی را شکست.
از آن زمان، تکنیکهای کلونینگ تکامل یافته و متنوع شدهاند و موجب پیشرفتهایی در پزشکی، کشاورزی و زیستشناسی حفاظت شدهاند.
انواع کلونینگ
کلونینگ یک فرآیند واحد نیست بلکه شامل انواع متعددی است که هرکدام اهداف علمی یا عملی متفاوتی را دنبال میکنند. این انواع را میتوان به طور کلی به موارد زیر تقسیم کرد:
۱. کلونینگ ژن
کلونینگ ژن شامل ساخت نسخههای دقیق از یک قطعه خاص DNA، معمولاً یک ژن، است. این تکنیک بنیادی در زیستشناسی مولکولی و بیوتکنولوژی است و امکان مطالعه ساختار و عملکرد ژنها، تولید پروتئینهای نوترکیب و مهندسی ژنتیک را فراهم میکند.
فرآیند معمولاً شامل مراحل زیر است:
-
جداسازی قطعه DNA حاوی ژن مورد نظر.
-
وارد کردن آن در یک بردار مانند پلاسمید که قادر به تکثیر مستقل در سلول میزبان است.
-
انتقال پلاسمید بازترکیب به سلول میزبان (معمولاً باکتری E. coli).
-
انتخاب و تکثیر سلولهایی که ژن کلونشده را دارند.
کلونینگ ژن امکان تولید داروهای حیاتی مانند انسولین، هورمونهای رشد و آنتیبادیهای منوکلونال را فراهم کرده است.
۲. کلونینگ تولید مثلی (بازتولیدی)
کلونینگ تولید مثلی به معنای ایجاد موجود جدیدی است که ژنتیکاً مشابه با موجود اهداکننده باشد. هدف این نوع کلونینگ تولید یک کپی زنده است، نه فقط سلولها یا بافتها.
روش اصلی این نوع کلونینگ، انتقال هسته سلول سوماتیک (SCNT) است که شامل انتقال هسته یک سلول بدنی از اهداکننده به یک تخمک فاقد هسته است. سپس تخمک بازسازیشده تحریک میشود تا به صورت یک جنین رشد کند و در رحم یک مادر جایگزین کاشته شود.
گوسفند دولی معروفترین نمونه کلونینگ تولید مثلی پستانداران است. به جز گوسفند، کلونینگ در گاو، موش، بز و گونههای دیگر نیز انجام شده است.
کلونینگ تولید مثلی وعدههایی در زمینه کشاورزی (تکثیر دامهای ممتاز)، حفاظت (نجات گونههای در معرض انقراض) و حتی تولید مثل انسان دارد، اما مورد دوم با چالشهای اخلاقی بسیار جدی روبروست.
۳. کلونینگ درمانی
کلونینگ درمانی، که به عنوان کلونینگ جنینی یا انتقال هسته سلول سوماتیک برای درمان نیز شناخته میشود، بر تولید سلولهای بنیادی جنینی مشابه ژنتیکی با اهداکننده تمرکز دارد. برخلاف کلونینگ تولید مثلی، جنینهای حاصل از کلونینگ درمانی به منظور ایجاد یک ارگانیسم کامل کاشته نمیشوند، بلکه به عنوان منبعی از سلولهای بنیادی استفاده میشوند که قادر به تمایز به هر نوع سلول بدن هستند.
هدف اصلی این نوع کلونینگ، تولید بافتها یا اندامهایی است که دستگاه ایمنی بیمار آنها را "خودی" شناسایی کند و از رد پیوند جلوگیری شود.
کلونینگ درمانی با پزشکی بازساختی همپوشانی دارد و امید به درمان بیماریهایی مانند پارکینسون، دیابت و آسیبهای نخاعی را به همراه دارد.
۴. کلونینگ سلولی
کلونینگ سلولی به تولید نسخههای مشابه از سلولها، اغلب از طریق رشد کلنیهای یکسان در آزمایشگاه اشاره دارد. این نوع کلونینگ برای تولید جمعیتهای خالص از سلولهای ژنتیکی یکسان برای پژوهش، آزمایش دارو یا درمان سلولی ضروری است.
این نوع کلونینگ معمولاً از طریق کشت سلولی انجام میشود، جایی که یک سلول منفرد به طور مکرر تقسیم شده و کلنیای از سلولهای همسان را ایجاد میکند.
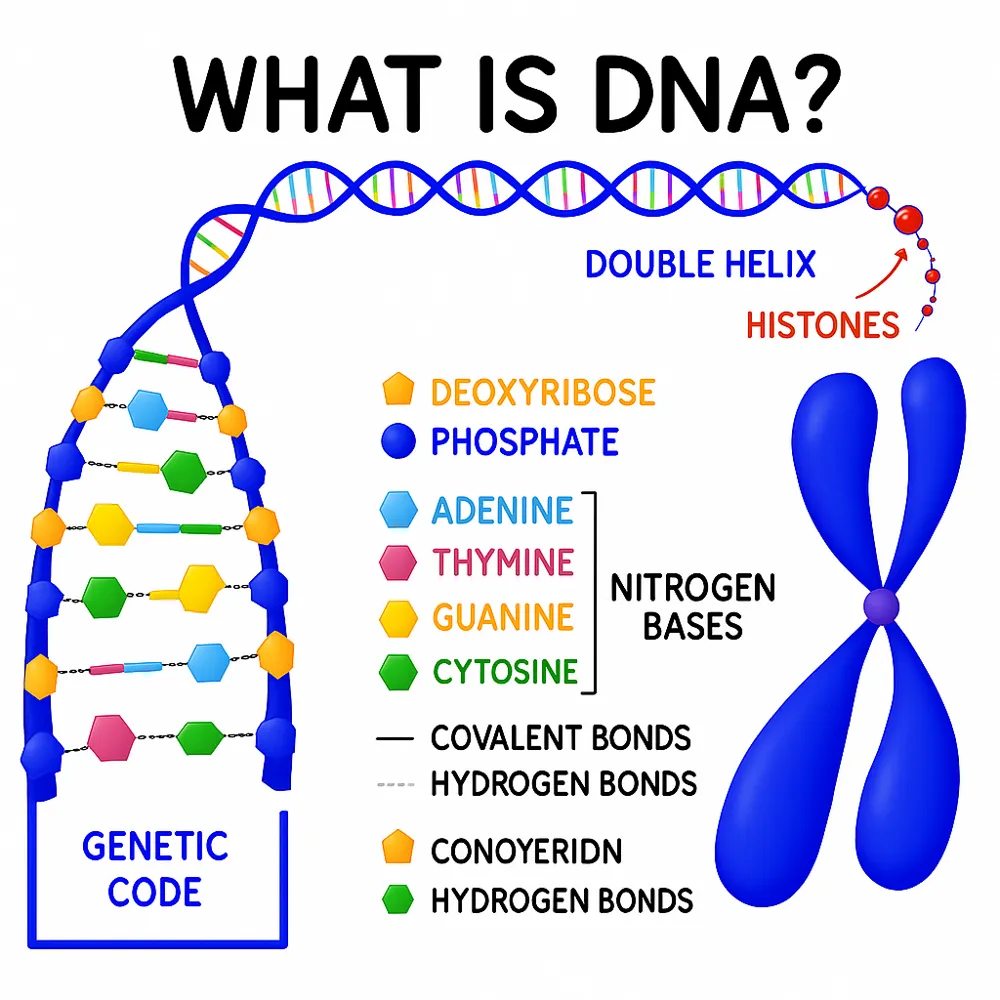
هویت ژنتیکی و تکثیر DNA
در مرکز کلونینگ، DNA قرار دارد که مولکولی است که دستورالعملهای ژنتیکی را حمل میکند. برای اینکه یک کلون ژنتیکیاً مشابه باشد، باید DNA هسته به طور دقیق و بدون تغییر کپی شده و منتقل شود. ژنوم شامل حدود ۳ میلیارد جفت باز (در انسان) است که تمام اطلاعات لازم برای رشد، عملکرد و تولیدمثل را رمزگذاری میکند.
برنامهریزی مجدد اپیژنتیکی
یکی از چالشهای مهم در کلونینگ، معکوس کردن تغییرات اپیژنتیکی—برچسبهای شیمیایی که بیان ژن را بدون تغییر در توالی DNA تنظیم میکنند—است. در سلولهای تمایز یافته، بسیاری از ژنهای لازم برای سلولهای دیگر یا توسعه جنینی به دلیل این برچسبها خاموش هستند.
برای موفقیت کلونینگ، این برچسبهای اپیژنتیکی باید پاک یا بازنشانی شوند تا "توانایی تمامکفایت" (totipotency)، یعنی توانایی تبدیل شدن به کل یک ارگانیسم، بازگردد. در SCNT، سیتوپلاسم تخمک شامل عواملی است که باعث برنامهریزی مجدد هسته منتقل شده میشود، اما این فرآیند کامل نیست و به همین دلیل بازده کلونینگ پایین است.
زیستشناسی رشد کلونینگ
پس از انتقال هسته، جنین مراحل متوالی رشد مانند تقسیم سلولی، تشکیل بلاستوسیت و کاشت در رحم را طی میکند. شکست در هر مرحله باعث کاهش موفقیت کلونینگ میشود. پژوهشها برای بهینهسازی شرایط رشد جنین سالم ادامه دارد.
روشهای کلونینگ
انتقال هسته سلول سوماتیک (SCNT)
این رایجترین تکنیک برای کلونینگ تولید مثلی و درمانی است:
-
جداسازی سلول سوماتیک اهداکننده (مثلاً فیبروبلاست پوست).
-
حذف هسته از تخمک گیرنده (بیهستهسازی).
-
انتقال هسته اهداکننده به تخمک بیهسته.
-
فعالسازی تخمک بازسازیشده به صورت شیمیایی یا الکتریکی برای تحریک تقسیم سلولی.
-
کشت جنین تا مرحله بلاستوسیت.
-
انتقال به رحم مادر جایگزین (کلونینگ تولید مثلی) یا استخراج سلولهای بنیادی جنینی (کلونینگ درمانی).
کلونینگ مولکولی
کلونینگ مولکولی از بردارهایی مانند پلاسمید یا باکتریوفاژ برای تکثیر قطعات DNA استفاده میکند. استراتژیهای مدرن همچنین از سیستمهای بازترکیب (مثلاً Gateway cloning)، مونتاژ Golden Gate یا ویرایش هدفمند با CRISPR برای کلونینگ و اصلاح دقیق ژنها بهره میبرند.
2. کلونینگ طبیعی و مصنوعی
کلونینگ طبیعی
کلونینگ پدیدهای نیست که صرفاً توسط بشر ابداع شده باشد. این فرآیند بهطور طبیعی در موارد زیر مشاهده میشود:
-
تولید مثل غیرجنسی در باکتریها و برخی گیاهان، نوعی کلونینگ طبیعی است.
-
دوقلوهای همسان در انسان و سایر حیوانات، از تقسیم طبیعی یک جنین و تولید دو موجود با DNA یکسان بهوجود میآیند.
-
بازسازی بدن در برخی جانوران مانند ستاره دریایی و کرمهای پهن، نوعی کلونسازی بافتها یا اندامهاست.
کلونینگ مصنوعی
کلونینگ مصنوعی فرایندی است که توسط انسان و با استفاده از تکنیکهای پیشرفته در آزمایشگاهها انجام میشود. این نوع از کلونینگ به سه دسته اصلی تقسیم میشود:
-
کلونینگ ژن
-
کلونینگ تولیدمثلی
-
کلونینگ درمانی
هر یک از این روشها کاربردها و تکنیکهای خاص خود را دارند که در ادامه بررسی میشوند.
3. انواع کلونینگ
3.1 کلونینگ ژن (Gene Cloning)
کلونینگ ژن که به آن کلونینگ DNA یا کلونینگ مولکولی نیز گفته میشود، به فرآیند کپیبرداری از یک قطعه خاص از DNA (معمولاً یک ژن) گفته میشود. این روش در زیستشناسی مولکولی برای تحقیقات، درمانها، و فناوریهای زیستی بهطور گستردهای استفاده میشود.
نحوه عملکرد:
-
ژن مورد نظر داخل یک ناقل (معمولاً پلاسمید) قرار میگیرد.
-
این DNA نوترکیب وارد سلول میزبان (معمولاً باکتری) میشود.
-
با تقسیم سلولهای میزبان، نسخههای زیادی از ژن تولید میشود.
کاربردها:
-
تولید انسولین انسانی توسط باکتریهای اصلاحشده.
-
مطالعه عملکرد ژنها و بیماریهای ژنتیکی.
-
تولید محصولات کشاورزی اصلاحشده ژنتیکی.
3.2 کلونینگ تولیدمثلی (Reproductive Cloning)
هدف کلونینگ تولیدمثلی، خلق یک موجود زنده است که از نظر ژنتیکی کاملاً مشابه با یک موجود دیگر باشد. این روش معمولاً با استفاده از تکنیکی به نام انتقال هسته سلول سوماتیک (Somatic Cell Nuclear Transfer - SCNT) انجام میشود.
فرایند:
-
هسته یک سلول بدنی (سوماتیک) از موجود دهنده گرفته میشود.
-
این هسته به داخل یک تخمک بدون هسته وارد میشود.
-
جنین حاصل تحریک میشود تا تقسیم شود و سپس به رحم یک موجود جانشین منتقل میشود.
نمونه معروف:
گوسفند دالی (Dolly) در سال 1996 – نخستین پستاندار کلونشده از یک سلول سوماتیک بزرگسال.
کاربردها:
-
کلونینگ گونههای در معرض انقراض یا منقرضشده (در حال آزمایش).
-
تولید دامهای اصلاحشده.
-
کاربرد احتمالی در کلونینگ انسان (بسیار بحثبرانگیز و در اغلب کشورها غیرقانونی است).
3.3 کلونینگ درمانی (Therapeutic Cloning)
کلونینگ درمانی یا کلونینگ جنینی، شامل ایجاد جنینهای کلونشده با هدف برداشت سلولهای بنیادی جنینی است. این سلولها قابلیت تبدیل به هر نوع سلولی در بدن را دارند و در پزشکی بازساختی ارزش فراوانی دارند.
نحوه عملکرد:
-
همان روش SCNT برای ایجاد جنین بهکار میرود.
-
بهجای انتقال جنین به رحم، آن را تا مرحله بلاستوسیست (حدود ۵ روزگی) رشد میدهند.
-
سپس سلولهای بنیادی استخراج شده و در درمان یا تحقیق استفاده میشوند.
کاربردها:
-
بازسازی بافتها یا اندامهای آسیبدیده.
-
درمان بیماریهایی مانند پارکینسون، آسیبهای نخاعی یا دیابت.
-
پزشکی شخصی مبتنی بر ماده ژنتیکی خود بیمار.
مسائل اخلاقی:
-
شامل تخریب جنین انسانی است.
-
سوالاتی درباره آغاز حیات و کرامت انسانی را مطرح میکند.
4. تاریخچه کلونینگ
ایده کلونینگ به آزمایشهای اولیه در قرن بیستم بازمیگردد، اما پیشرفتهای واقعی تنها در چند دهه اخیر رخ دادهاند.
نقاط عطف مهم:
-
1952: کلون یک قورباغه توسط رابرت بریگز و توماس کینگ با استفاده از انتقال هسته.
-
1973: نخستین ژن کلونشده توسط هربرت بویِر و استنلی کوهن.
-
1996: تولد گوسفند دالی.
-
2001 تا 2003: کلون حیواناتی مانند گاو، خوک، گربه و سگ.
-
2005: ادعای دانشمندان کرهای درباره کلون انسان (بعداً مشخص شد جعلی است).
-
2018: دانشمندان چینی موفق به کلون میمون شدند که بحث کلون انسان را جدیتر کرد.
5. کاربردهای کلونینگ
کلونینگ در صنایع مختلف و شاخههای علمی کاربردهای گستردهای دارد.
5.1 پزشکی
-
ژندرمانی: وارد کردن ژنهای سالم برای درمان بیماریهای ژنتیکی.
-
تحقیقات سلولهای بنیادی: توسعه درمانهای بیماریهای تخریبکننده.
-
داروسازی: تولید پروتئینها و هورمونهایی مانند انسولین.
-
بازسازی اندامها: در آینده امکان رشد اندام برای پیوند از سلولهای خود بیمار.
5.2 کشاورزی و دامپروری
-
کلون دامها: برای صفات مطلوب مانند تولید شیر بالا یا مقاومت به بیماری.
-
حفظ نژادهای برتر: کلونینگ حیوانات با عملکرد بالا.
-
کلون حیوانات خانگی: برخی شرکتها حیوانات خانگی مانند سگ و گربه را کلون میکنند (مثلاً ViaGen Pets).
5.3 حفاظت از گونهها
-
نجات گونههای در خطر: تلاش برای احیای حیواناتی مانند بز کوهی اسپانیایی (Bucardo).
-
حفظ تنوع زیستی: ذخیره و تکثیر ماده ژنتیکی حیوانات و گیاهان نادر.
5.4 تحقیقات علمی
-
مطالعه رشد و پیشرفت بیماریها.
-
ایجاد حیوانات اصلاحشده ژنتیکی برای آزمایشات.
-
درک عملکرد ژنها با حذف یا دستکاری آنها (کلونینگ خاموشسازی ژن).
کلونسازی DNA که با عناوینی مانند کلونسازی ژن یا کلونسازی مولکولی نیز شناخته میشود، یک تکنیک اساسی در زیستشناسی مولکولی است که به دانشمندان اجازه میدهد نسخههای یکسانی از یک قطعه خاص DNA تولید کنند. از زمان پیدایش آن در دهه ۱۹۷۰، کلونسازی DNA به ابزاری غیرقابلجایگزین در تحقیقات ژنتیکی، زیستفناوری، تولید دارو، کشاورزی و حتی تشخیصهای پزشکی تبدیل شده است. این روش قدرتمند نه تنها درک ما از ماده ژنتیکی و بیان ژنها را دگرگون کرده، بلکه به توسعه موجودات تراریخته (GMOs)، ژندرمانی و زیستشناسی سنتزی نیز منجر شده است.
در اینجا به بررسی اصول، روشها، کاربردها، سیر تاریخی و ملاحظات اخلاقی مرتبط با کلونسازی DNA میپردازیم.
1. درک مفهوم کلونسازی DNA
در بنیادیترین شکل، کلونسازی DNA به معنای جداسازی و تکثیر یک توالی خاص از DNA برای تولید نسخههای متعدد و یکسان از آن است. هدف اصلی این تکنیک، تجزیه و تحلیل، دستکاری یا بیان ژنها در یک محیط کنترلشده است. برخلاف کلونسازی کل ارگانیسم که منجر به تولید موجوداتی کاملاً یکسان میشود، کلونسازی DNA در سطح مولکولی انجام شده و معمولاً فقط بر روی یک ژن یا قطعهای از آن تمرکز دارد.
واژه "کلون" از واژه یونانی klon به معنای "شاخه گیاه" گرفته شده که استعارهای مناسب است؛ چراکه در ابتدا کلونسازی به تکثیر گیاهان از طریق قلمهزنی اشاره داشت. در زیستشناسی مولکولی، کلونسازی DNA به معنای تکثیر دقیق یک قطعه DNA و وارد کردن آن به یک موجود زنده میزبان—معمولاً باکتریها—برای نگهداری، تکثیر یا بررسیهای بعدی است.
2. دیدگاه تاریخی و سیر تکامل
ایده دستکاری DNA به دهههای ۱۹۵۰ و ۶۰ بازمیگردد، اما دوران مدرن کلونسازی DNA در سال ۱۹۷۳ با کار پیشگامانه هربرت بویر و استنلی کوهن آغاز شد. آنها برای اولین بار یک ژن خارجی را وارد یک پلاسمید باکتریایی کرده و آن را به باکتری اشرشیا کلی منتقل کردند، که منجر به تولید نخستین موجود تراریخته شد. این پیشرفت پایهگذار فناوری DNA نوترکیب بود و راه را برای زیستفناوری مدرن گشود.
پس از این پیشرفت، دانشمندان روشهای برش، اتصال و تکثیر قطعات DNA را به سرعت بهبود دادند و موجب گسترش جهانی کلونسازی در آزمایشگاهها شدند. کشف واکنش زنجیرهای پلیمراز (PCR) در دهه ۱۹۸۰ نیز انقلابی دیگر در زیستشناسی مولکولی بود که امکان تکثیر DNA بدون استفاده از سلولهای زنده را فراهم کرد. با این حال، کلونسازی DNA هنوز هم در کاربردهایی که به بیان ژن، نگهداری بلندمدت یا تولید پروتئین نیاز دارند، ضروری است.
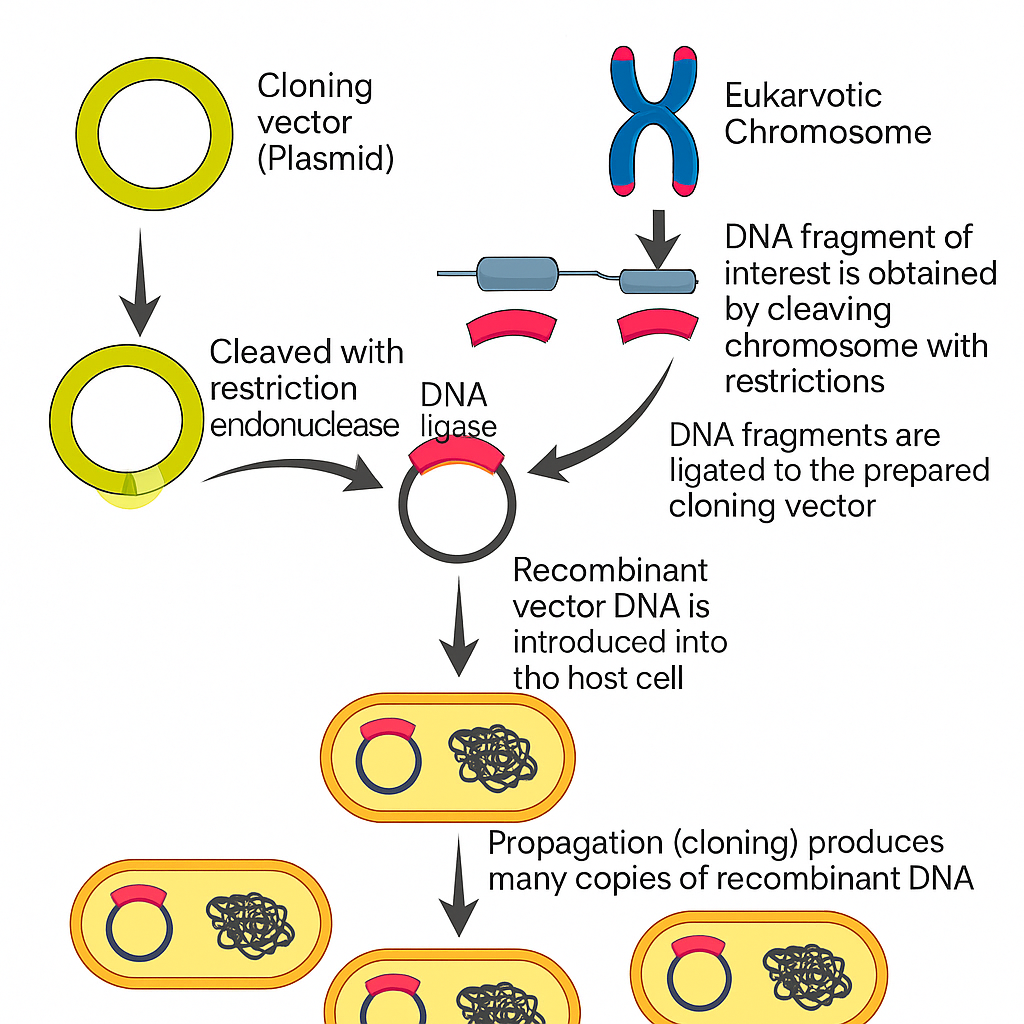
3. اجزا و مراحل کلونسازی DNA
فرآیند کلونسازی DNA پیچیده و چند مرحلهای است و نیاز به ابزارهای مولکولی، موجودات میزبان و تکنیکهای آزمایشگاهی دارد. مراحل اصلی آن عبارتند از:
3.1 انتخاب قطعه DNA
نخستین مرحله شناسایی ژن یا توالی مورد نظر است. این DNA میتواند از DNA ژنومی، DNA مکمل (cDNA) تولید شده از mRNA یا از طریق سنتز شیمیایی به دست آید.
3.2 استفاده از آنزیمهای برشدهنده (Restricion Enzymes)
پس از جداسازی DNA هدف، آنزیمهای برشدهنده که به عنوان قیچی مولکولی عمل میکنند، برای برش دقیق قطعه مورد نظر استفاده میشوند. پلاسمید یا وکتور نیز با همان آنزیمها بریده میشود تا امکان درج DNA خارجی فراهم شود.
3.3 درج در وکتور
وکتور یک مولکول DNA قابل تکثیر است که نقش حامل DNA خارجی را دارد. رایجترین وکتورها شامل پلاسمیدها، باکتریوفاژها، کاسمیدها و کروموزومهای مصنوعی هستند. DNA هدف توسط آنزیم DNA لیگاز به وکتور متصل میشود.
3.4 انتقال به سلول میزبان
مولکول DNA نوترکیب به سلول میزبان (معمولاً E. coli) منتقل میشود. این انتقال با روشهایی مانند تیمار شیمیایی یا الکتروپوریشن (استفاده از جریان الکتریکی) انجام میشود.
3.5 انتخاب و غربالگری
از آنجا که همه سلولها موفق به دریافت DNA نوترکیب نمیشوند، ژنهای نشانگر مانند مقاومت به آنتیبیوتیک در وکتور قرار داده میشوند. فقط سلولهایی که وکتور را دارند در محیط حاوی آنتیبیوتیک زنده میمانند. غربالگری بیشتر با روشهایی مانند PCR یا روش آبی-سفید انجام میشود.
3.6 تکثیر و استخراج
پس از شناسایی سلولهای موفق، آنها در مقیاس بزرگ کشت داده میشوند تا پلاسمید نوترکیب تکثیر یابد. سپس DNA استخراج و خالصسازی شده و برای کاربردهای بعدی مانند توالییابی، بیان ژن یا تولید پروتئین به کار میرود.
4. انواع وکتورهای مورد استفاده در کلونسازی
انتخاب وکتور مناسب بستگی به هدف آزمایش دارد:
-
پلاسمیدها: مناسب برای کلونسازی قطعات کوچک DNA.
-
باکتریوفاژها (فاژ لامبدا): برای قطعات بزرگتر DNA و ساخت کتابخانههای ژنومی.
-
کاسمیدها: ترکیبی از پلاسمید و فاژ؛ ظرفیت حمل تا ۴۵ کیلوباز DNA.
-
کروموزومهای مصنوعی باکتریایی و مخمری (BAC و YAC): برای کلونسازی توالیهای بسیار بزرگ، مانند کروموزومها.
5. کاربردهای کلونسازی DNA
کلونسازی DNA کاربردهای گستردهای در علم و صنعت دارد، از جمله:
5.1 بیان ژن و تولید پروتئین
ژنهای کلونشده به وکتورهای بیانی وارد میشوند تا پروتئین تولید کنند. این روش در صنایع دارویی برای تولید انسولین، هورمون رشد، اریتروپویتین و فاکتورهای انعقادی استفاده میشود.
5.2 پژوهش ژنتیکی و ژنومیک عملکردی
کلونسازی ابزار اصلی مطالعه عملکرد ژنها از طریق افزایش بیان، ایجاد جهش یا حذف ژن است. این مطالعات به فهم فرآیندهای زیستی، رشد و بیماری کمک میکنند.
5.3 ژندرمانی
در ژندرمانی، نسخههای سالم ژنها کلون شده و برای درمان بیماریهای ژنتیکی به سلولهای بیمار منتقل میشوند. این حوزه در حال رشد است و برخی درمانها برای بیماریهای نادر تصویب شدهاند.
5.4 موجودات تراریخته (GMOs)
کلونسازی پایه مهندسی ژنتیک گیاهان و حیوانات است. ویژگیهایی مانند مقاومت به آفات یا بهبود ارزش تغذیهای از این طریق منتقل میشوند.
5.5 توسعه واکسنها
ژنهای ویروسی کلونشده برای ساخت واکسنهای نوترکیب مانند واکسن هپاتیت B به کار میروند. همچنین این تکنیک به توسعه واکسنهای mRNA کمک کرده است.
5.6 پزشکی قانونی و تشخیص بیماری
کلونسازی DNA در پزشکی قانونی برای شناسایی هویت و در آزمایشهای ژنتیکی برای تشخیص بیماریها و جهشهای ژنی کاربرد دارد.
اهداف شبیهسازی DNA از مطالعات علمی بنیادی گرفته تا نتایج فناورانه کاربردی گستردهاند. در هسته خود، شبیهسازی DNA بهمعنای کنترل یک قطعه خاص از DNA است تا بتوان آن را مطالعه، تغییر یا در زمینه دلخواهی استفاده کرد. اهداف اصلی این تکنیک را میتوان در چند حوزه کلی و در عین حال مرتبط دستهبندی کرد:
۱. شناسایی و تحلیل عملکرد ژن
یکی از پایهایترین اهداف شبیهسازی DNA، شناسایی ساختار، توالی، عملکرد و مکانیزمهای تنظیمی ژنها است. با جداسازی یک ژن و وارد کردن آن به یک ناقل کنترلی، پژوهشگران میتوانند ژن را در ارگانیسمهای مدل یا سلولهای کشتشده بیان کرده و محصول پروتئینی حاصل، رفتار تنظیمی و تأثیرات سلولی آن را مطالعه کنند. این روش برای درک عملکرد ژنها، کشف مسیرهای بیوشیمیایی و شناسایی پایه ژنتیکی بیماریها ضروری است.
برای مثال، شبیهسازی ژن مسئول فیبروز کیستیک (CFTR) این امکان را فراهم کرد تا پژوهشگران بتوانند پروتئین معیوب را بررسی کرده و درمانهای هدفمند توسعه دهند. بدون امکان شبیهسازی و بیان این ژن در سیستمهای مدل، دستیابی به این اطلاعات غیرممکن بود.
۲. تولید پروتئین برای درمان و پژوهش
هدف عمده دیگر، تولید پروتئینهای نوترکیب در مقیاس بالا است. با وارد کردن ژن مورد نظر به سیستمهای بیانی باکتریایی، مخمری یا پستانداری، از این ارگانیسمها به عنوان کارخانههای زیستی استفاده میشود. این روش در صنعت داروسازی بهطور گسترده برای تولید انسولین، هورمون رشد انسانی، آنتیبادیهای مونوکلونال و دیگر پروتئینهای درمانی استفاده میشود.
تولید این پروتئینها از منابع طبیعی بسیار پرهزینه و ناکارآمد خواهد بود، اما شبیهسازی DNA راهکاری مقرونبهصرفه و مقیاسپذیر ارائه میدهد.
۳. مهندسی ژنتیک و زیستشناسی ساختاری
شبیهسازی DNA مبنای مهندسی ژنتیک است؛ جایی که ژنها برای عملکرد جدید اصلاح، ترکیب یا بهینهسازی میشوند. در کشاورزی، ژنهای شبیهسازیشده به گیاهان منتقل میشوند تا مقاومت به آفات، تحمل به تنشهای محیطی یا ارزش تغذیهای افزایش یابد. در زیستشناسی ساختاری (Synthetic Biology)، مسیرهای مصنوعی یا مدارهای ژنتیکی جدید با مونتاژ ژنهای شبیهسازیشده ساخته میشوند.
تولید ارگانیسمهای تراریخته (GMOs)، از جمله حیوانات و گیاهان تراریخته، بهواسطه همین روشهای دقیق شبیهسازی ژنتیکی ممکن شده است.
۴. ژندرمانی و پزشکی شخصی
در تحقیقات بالینی، یکی از بلندپروازانهترین اهداف شبیهسازی DNA، ژندرمانی است؛ یعنی اصلاح نواقص ژنتیکی از طریق انتقال ژنهای عملکردی به سلولهای بیمار. شبیهسازی امکان آمادهسازی توالیهای ژنی مناسب برای انتقال از طریق وکتورهای ویروسی یا غیرویروسی را فراهم میکند. پس از وارد شدن این توالیها به سلولهای بیمار، عملکرد طبیعی بازیابی شده یا اثرات ژن معیوب خنثی میشوند.
پزشکی شخصی نیز از شبیهسازی بهره میبرد؛ زیرا توالیهای شبیهسازیشده اختصاصی بیمار میتوانند در توسعه درمانها، تشخیصها و پیشبینیهای فردی مورد استفاده قرار گیرند.
۵. ژنومیک تطبیقی و تکاملی
شبیهسازی همچنین در مطالعات تکاملی اهمیت دارد، زیرا امکان تحلیل ژنهای همولوگ بین گونههای مختلف را فراهم میکند. با مقایسه ژنهای شبیهسازیشده در موجودات مختلف، میتوان تاریخچه تکاملی خانوادههای ژنی، حفظ عملکرد ژنتیکی و فرآیندهای تمایز گونهای را مطالعه کرد.
بخش دوم: روشهای شبیهسازی DNA
فرآیند شبیهسازی DNA شامل مجموعهای از مراحل مولکولی دقیق و بههمپیوسته است که هر یک نیازمند ابزارها، آنزیمها و راهبردهای خاصی هستند. اگرچه روشها بسته به هدف نهایی و نوع میزبان متفاوت است، اما اصول اصلی آن معمولاً شامل مراحل زیر میشود:
۱. استخراج و آمادهسازی DNA مورد نظر
نخستین گام، شناسایی و جداسازی قطعه DNA مورد نظر است. این قطعه میتواند از DNA ژنومی، cDNA (ساختهشده از mRNA) یا الیگونوکلئوتیدهای سنتز شده بهدست آید.
اگر هدف شبیهسازی یک توالی کدکننده باشد، معمولاً cDNA به دلیل حذف اینترونها گزینه بهتری در یوکاریوتهاست. آنزیم رونوشتبردار معکوس (Reverse Transcriptase) برای ساخت نسخهای بدون اینترون از mRNA به کار میرود. سپس، واکنش زنجیرهای پلیمراز (PCR) برای تقویت این توالی و افزودن نواحی خاص مانند سایتهای برش استفاده میشود.
۲. برش DNA با آنزیمهای محدودکننده
آنزیمهای برشدهنده یا اندونوکلئازهای محدودکننده آنزیمهایی باکتریایی هستند که توالیهای خاص DNA را شناسایی و برش میدهند. این برشها ممکن است به صورت انتهای صاف (blunt ends) یا چسبنده (sticky ends) باشند که برای اتصال به ناقل مهماند.
برای آمادهسازی ناقل و قطعه DNA برای اتصال، هر دو با آنزیمهای سازگار بریده میشوند تا انتهای مکمل تشکیل شود.
۳. انتخاب ناقل (وکتور) مناسب
وکتور یک مولکول DNA حامل است که میتواند DNA خارجی را منتقل کرده و درون میزبان تکثیر شود. یک وکتور مناسب دارای ویژگیهای زیر است:
-
مبدا همانندسازی (Ori) برای تکثیر در میزبان
-
مارکر انتخابی (مانند ژن مقاومت به آنتیبیوتیک)
-
سایت چندبرشی (MCS) حاوی چندین سایت برای آنزیمهای برش
انواع رایج وکتورها:
-
پلاسمیدها: رایجترین وکتورها برای شبیهسازی ساده
-
باکتریوفاژها: برای توالیهای بزرگ
-
کاسمیدها، BAC و YAC: برای شبیهسازی ژنومها و قطعات بسیار بزرگ
۴. اتصال قطعه DNA به ناقل (لیگاسیون)
پس از برش، قطعه و ناقل خالصسازی شده و در حضور آنزیم DNA لیگاز با یکدیگر مخلوط میشوند. این آنزیم پیوند فسفودیاستر بین دو قطعه ایجاد میکند.
برای افزایش کارایی، نسبت مولار و دما تنظیم میشود. لیگاسیون با انتهای چسبنده معمولاً کارآمدتر است. برای جلوگیری از لیگاسیون خودکار ناقل، ممکن است از آنزیم فسفاتاز قلیایی برای حذف گروه فسفات استفاده شود.
۵. وارد کردن وکتور نوترکیب به میزبان
پس از ساخت DNA نوترکیب، آن را به میزبان (معمولاً E. coli) وارد میکنند. روشهای متداول انتقال:
-
ترانسفورماسیون شیمیایی (با CaCl₂)
🧪 مراحل انجام ترانسفورماسیون شیمیایی با CaCl₂:
-
آمادهسازی سلولهای شایسته:
-
سلولهای باکتری (مثلاً E. coli) در مرحله رشد لگاریتمی برداشت میشوند.
-
در حضور محلول یخسرد کلرید کلسیم (CaCl₂) قرار میگیرند.
-
این کار باعث تثبیت بارهای منفی روی غشای سلول و DNA میشود، در نتیجه غشاء نفوذپذیرتر شده و DNA راحتتر وارد سلول میشود.
-
-
افزودن DNA خارجی (مثلاً پلاسمید):
-
DNA مورد نظر به سلولهای شایسته اضافه میشود.
-
-
شوک حرارتی (Heat Shock):
-
مخلوط سلول و DNA بهمدت حدود 30–90 ثانیه در دمای حدود 42 درجه سانتیگراد قرار داده میشود.
-
این شوک حرارتی باعث ایجاد حفرههای موقتی در غشای سلول میشود که امکان ورود DNA را فراهم میکند.
-
-
ریکاوری و رشد:
-
سلولها در محیط کشت بدون آنتیبیوتیک (مثلاً LB) قرار میگیرند تا به حالت پایدار برسند.
-
سپس روی محیطهای انتخابی (مثلاً با آنتیبیوتیک) کشت داده میشوند تا فقط سلولهایی که DNA خارجی را جذب کردهاند رشد کنند.
-
-
الکتروپوریشن (استفاده از میدان الکتریکی)
🧪 مراحل انجام الکتروپوریشن:
-
آمادهسازی سلولهای شایسته (competent cells):
-
سلولها باید در شرایط خاصی (بدون نمک، در بافرهای مخصوص مانند گلیسیرول یا آب) آماده شوند.
-
-
مخلوط کردن سلولها با DNA:
-
DNA خارجی (مثل پلاسمید) به سلولها اضافه میشود.
-
-
اعمال پالس الکتریکی:
-
مخلوط سلول و DNA در یک دستگاه به نام الکتروپوراتور قرار میگیرد.
-
یک ولتاژ کوتاه ولی بسیار قوی (معمولاً چند صد تا چند هزار ولت) اعمال میشود.
-
این پالس الکتریکی باعث ایجاد منافذ موقت در غشای سلول میشود.
-
-
ریکاوری سلولها:
-
سلولها بلافاصله در محیط کشت غنی (مثل SOC یا LB) منتقل میشوند تا غشای خود را ترمیم کنند و DNA وارد شده تثبیت شود.
-
-
انتخاب سلولهای ترنسفورم شده:
-
معمولاً سلولها روی محیطهای حاوی آنتیبیوتیک کشت داده میشوند تا فقط سلولهایی که DNA را دریافت کردهاند، رشد کنند.
-
-
میکرواینجکشن یا بمباران ژنی برای سلولهای یوکاریوتی یا گیاهی
در زیستفناوری و مهندسی ژنتیک، یکی از مهمترین چالشها، وارد کردن ماده ژنتیکی خارجی (مانند DNA نوترکیب) به داخل سلولهای یوکاریوتی (حیوانی یا گیاهی) است. در سلولهای پروکاریوتی، روشهایی مانند ترانسفورماسیون شیمیایی یا الکتروپوریشن پاسخگو هستند، اما در یوکاریوتها—بهویژه سلولهای سختپوست مانند سلولهای گیاهی یا سلولهای بزرگ مانند سلول تخم—روشهای دقیقتر و فیزیکیتری مورد نیاز است. در این میان، میکرواینجکشن و بمباران ژنی (بیولیستیک) از جمله روشهای نوین و قدرتمند برای این منظور هستند.
🧬 ۱. میکرواینجکشن (Microinjection)
میکرواینجکشن روشی فیزیکی است که طی آن، DNA خارجی بهوسیلهی یک سوزن بسیار نازک (میکروپیپت) مستقیماً به داخل هسته یا سیتوپلاسم سلول یوکاریوتی تزریق میشود. این تکنیک تحت میکروسکوپ و با ابزارهای بسیار دقیق انجام میگیرد.
🔹 مراحل انجام:
-
سلولهای زنده، معمولاً سلول تخم یا زیگوت، در زیر میکروسکوپ ثابت میشوند.
-
میکروپیپت حاوی DNA بهآرامی به داخل سلول وارد میشود.
-
مقدار مشخصی DNA به داخل هسته یا سیتوپلاسم تزریق میشود.
-
سلول سپس در محیط کشت مناسب نگهداری میشود تا رشد کند و ژن تزریقشده را بیان کند.
🔹 کاربردها:
-
تولید حیوانات تراریخته مانند موشهای آزمایشگاهی با ژن خاص.
-
مطالعه عملکرد و تنظیم ژنها.
-
روش مکمل در سیستمهای ویرایش ژنوم مانند CRISPR-Cas9.
🔹 مزایا:
-
کنترل بسیار بالا بر محل و مقدار تزریق.
-
مناسب برای سلولهای بزرگ و خاص مانند سلول تخم.
🔹 معایب:
-
زمانبر و نیازمند تخصص بالا.
-
کارایی پایین در مقیاس انبوه.
-
محدود به سلولهایی با اندازه بزرگ.
🌽 ۲. بمباران ژنی (Gene Gun / Biolistic Transformation)
بمباران ژنی یا روش بیولیستیک، روشی فیزیکی برای انتقال ژن است که در آن DNA خارجی ابتدا بر روی ذرات ریز فلزی (مانند طلا یا تنگستن) پوشانده شده و سپس با فشار زیاد به داخل سلولها شلیک میشود. این روش بهویژه در گیاهانی که دیواره سلولی ضخیم دارند، بسیار مؤثر است.
🔹 مراحل انجام:
-
ذرات فلزی (در حد نانو یا میکرومتر) با DNA پوشانده میشوند.
-
این ذرات درون دستگاه تفنگ ژنی قرار میگیرند.
-
با استفاده از فشار گاز (معمولاً هلیوم)، ذرات با سرعت بالا به داخل بافت گیاهی یا سلولی شلیک میشوند.
-
برخی از این ذرات وارد سلول میشوند و DNA متصل به آنها در ژنوم سلول میزبان قرار میگیرد.
🔹 کاربردها:
-
تولید گیاهان تراریخته مانند برنج، ذرت و گندم مقاوم به آفت یا خشکی.
-
وارد کردن ژن به کلروپلاست یا اندامکهای خاص.
-
انتقال ژن به بافتهای سخت و غیر قابل نفوذ برای سایر روشها.
🔹 مزایا:
-
امکان استفاده برای انواع سلولها، بهویژه سلولهای گیاهی با دیواره سلولی ضخیم.
-
مناسب برای مقیاسهای آزمایشگاهی تا نیمهصنعتی.
🔹 معایب:
-
احتمال آسیب مکانیکی به سلولها.
-
محل ورود DNA تصادفی و غیرقابل کنترل است.
-
نیاز به تجهیزات نسبتاً گرانقیمت.
پس از ورود، ناقل تکثیر شده و در صورت وجود پروموتر مناسب، ژن مورد نظر بیان میشود.
۶. انتخاب و غربالگری سلولهای نوترکیب
همه سلولها وکتور نوترکیب دریافت نمیکنند، بنابراین نیاز به انتخاب و غربالگری وجود دارد:
-
آنتیبیوتیک: فقط سلولهای حاوی وکتور زنده میمانند
-
غربالگری سفید-آبی: اختلال در ژن lacZ (رنگ سفید = موفق)
-
PCR، هیبریداسیون یا نقشهبرداری محدودکننده برای تأیید صحت
۷. تکثیر و آنالیز نهایی
سلولهای مثبت در مقیاس بالا رشد داده شده و DNA نوترکیب یا پروتئین هدف استخراج میشود. سپس:
-
توالییابی برای تأیید ژن
-
تحلیل بیان ژن یا پروتئین
-
خالصسازی پروتئین با استفاده از تگهایی مانند His-tag
بخش سوم: نوآوریها و چشمانداز آینده
اگرچه روشهای کلاسیک شبیهسازی همچنان بنیادی هستند، اما تکنیکهای نوین مانند Gibson Assembly، Golden Gate و Gateway Cloning، امکان مونتاژ بدون درز و چندبخشی DNA را بدون نیاز به آنزیمهای برش فراهم کردهاند.
همچنین فناوری ویرایش ژن با CRISPR-Cas9 مکمل شبیهسازی بوده و امکان وارد کردن دقیق ژنها در محلهای خاص ژنومی را فراهم میکند.
در زیستشناسی ساختاری، امکان سنتز کامل ژنها از نو (de novo synthesis) فراهم شده است، که همراه با هوش مصنوعی و اتوماسیون، چشماندازی از شبیهسازی DNA بهصورت ماژولار، با توان عملیاتی بالا و قابل برنامهریزی را ترسیم میکند.
ترنسفورمیشن باکتریایی: مکانیسمهای جذب DNA و آمادهسازی سلولهای کامپتنت
ترنسفورمیشن باکتریایی—فرآیندی که طی آن باکتریها DNA خارجی را از محیط اطراف خود جذب کرده و یا در ژنوم خود ادغام میکنند یا بهصورت عناصر خارجکروموزومی حفظ مینمایند—یکی از ارکان اصلی زیستشناسی مولکولی، بیوتکنولوژی و مهندسی ژنتیک محسوب میشود. این پدیده نخستین بار توسط "فردریک گریفیث" در سال ۱۹۲۸ و در جریان مطالعاتش بر روی Streptococcus pneumoniae کشف شد و یکی از نخستین شواهد مبنی بر اینکه DNA مولکول وراثتی است، فراهم آورد. از آن زمان، ترنسفورمیشن به یک تکنیک حیاتی آزمایشگاهی تبدیل شده است که امکان دستکاری ژنها، بیان پروتئینهای نوترکیب، ساخت کتابخانههای ژنی و مهندسی موجودات زنده برای تحقیقات بنیادی و کاربردی را فراهم میآورد.
این مقاله به بررسی زیربنای بیولوژیکی جذب DNA در باکتریها، تمایز میان ترنسفورمیشن طبیعی و مصنوعی، و مروری جامع بر نحوه آمادهسازی سلولهای کامپتنت در شرایط آزمایشگاهی جهت تسهیل جذب DNA میپردازد. درک اصول، مکانیسمها و روشهای عملی ترنسفورمیشن برای هر پژوهشگر زیستشناسی مولکولی ضروری است.
I. ترنسفورمیشن طبیعی: مکانیسمهای زیستی و نقش اکولوژیک
1.1 مفهوم "کامپتنت" در ترنسفورمیشن طبیعی
در طبیعت، برخی گونههای باکتریایی دارای توانایی ذاتی برای جذب DNA خارجی از محیط اطراف خود هستند. این فرآیند که "ترنسفورمیشن طبیعی" نامیده میشود، نیازمند ایجاد یک وضعیت فیزیولوژیکی خاص بهنام "کامپتنس" (competence) است. کامپتنس یک ویژگی دائمی نیست، بلکه در پاسخ به محرکهای محیطی خاص مانند کمبود مواد مغذی، تراکم جمعیتی یا سیگنالهای استرسی القا میشود. از جمله باکتریهای ذاتاً کامپتنت میتوان به Bacillus subtilis، Streptococcus pneumoniae، Neisseria gonorrhoeae و Haemophilus influenzae اشاره کرد.
توسعه کامپتنس یک فرآیند تنظیمشده ژنتیکی است که در آن مجموعهای از پروتئینها برای اتصال، انتقال و ادغام DNA بیان میشوند. در Bacillus subtilis، بهعنوان مثال، کامپتنس توسط مسیر کوئوروم-سنسینگ پیچیدهای کنترل میشود که تنظیمکننده اصلی آن پروتئینی به نام ComK است. این پروتئین باعث فعالسازی ژنهای لازم برای جذب و پردازش DNA میگردد.
1.2 ماشین جذب DNA در باکتریهای ذاتاً کامپتنت
ماشین جذب DNA در باکتریهای ذاتاً کامپتنت معمولاً شامل کمپلکسهای چندپروتئینی است که در غشای سلولی یا پوشش سلولی مستقرند. فرآیند جذب DNA شامل مراحل متوالی زیر است:
-
اتصال DNA: مولکول DNA دو رشتهای به پروتئینهای گیرندهای که در سطح سلول قرار دارند متصل میشود. در برخی موارد، مانند Neisseria، DNA باید دارای توالیهای خاصی باشد که قابل شناسایی توسط گیرندهها هستند، ولی در گونههایی مانند Bacillus subtilis، جذب DNA غیر اختصاصیتر است.
-
پردازش DNA: پس از اتصال، یکی از رشتههای DNA توسط نوکلئازهای وابسته به غشا تخریب شده و رشته مکمل آن از طریق غشا به داخل سیتوپلاسم منتقل میشود.
-
ادغام: رشته تکگانه وارد شده به کمک پروتئینهای متصلشونده به DNA تکرشتهای (SSBs) پوشانده میشود و ممکن است تحت نوترکیبی همولوگ قرار گرفته و با کمک RecA در ژنوم سلول میزبان ادغام شود.
این فرآیند نهتنها بهعنوان یک مکانیزم برای ایجاد تنوع ژنتیکی و سازگاری عمل میکند، بلکه ممکن است نقشهایی در ترمیم DNA و تأمین مواد مغذی نیز ایفا کند.
II. ترنسفورمیشن مصنوعی: بهرهبرداری از جذب DNA در آزمایشگاه
اگرچه ترنسفورمیشن طبیعی از نظر زیستی بسیار جذاب است، اما محدود به تعداد کمی از گونههای باکتریایی است. برای اهداف مهندسی ژنتیک، دانشمندان روشهایی برای القای مصنوعی کامپتنس در طیف وسیعی از باکتریها، بهویژه Escherichia coli که رایجترین میزبان در کلونینگ مولکولی است، توسعه دادهاند.
ترنسفورمیشن مصنوعی شامل ایجاد شرایط فیزیکی یا شیمیایی است که باعث افزایش نفوذپذیری غشای سلولی نسبت به DNA پلاسمیدی میشود. دو روش رایج در آزمایشگاه عبارتاند از: ترنسفورمیشن شیمیایی با استفاده از کلرید کلسیم، و الکتروپوریشن که از پالسهای ولتاژ بالا استفاده میکند.
III. ترنسفورمیشن شیمیایی: روش کلرید کلسیم
3.1 پیشزمینه تاریخی و اصل پایه
روش استفاده از کلرید کلسیم برای القای کامپتنس در E. coli نخستین بار در دهه ۱۹۷۰ گزارش شد. اصل این روش بر این است که کاتیونهای دوظرفیتی مانند Ca²⁺ با خنثیکردن بارهای منفی روی مولکول DNA و سطح سلول باکتری—که بهدلیل ستون فوسفاتی و لایههای LPS دارای بار منفی هستند—به جذب DNA کمک میکنند.
درمان با کلرید کلسیم معمولاً در دمای پایین (روی یخ) انجام میشود تا غشای سلولی پایدار بماند. سپس یک مرحله شوک حرارتی (heat shock) در دمای ۴۲ درجه سانتیگراد برای ۳۰ تا ۹۰ ثانیه انجام میشود که باعث ایجاد عدم تعادل حرارتی در غشا و تشکیل روزنههای گذرا میشود که DNA از آنها وارد سلول میگردد.
3.2 آمادهسازی سلولهای کامپتنت شیمیایی
برای تهیه سلولهای E. coli کامپتنت به روش شیمیایی، مراحل زیر دنبال میشود:
-
انتخاب فاز رشد: کشت تازهای از باکتری در محیط LB تا فاز میانی رشد لگاریتمی (OD₆₀₀ حدود ۰.۴–۰.۶) رشد داده میشود. در این مرحله، سلولها فعالترین وضعیت متابولیکی را دارند و غشای سیالتری دارند.
-
درمان با کلرید کلسیم سرد: سلولها روی یخ سرد شده و با سانتریفیوژ جمعآوری میشوند. سپس بهآرامی در محلول سرد ۵۰–۱۰۰ میلیمولار کلرید کلسیم بازتعلیق میشوند. ممکن است چندین مرحله شستوشو با CaCl₂ سرد برای حذف محیط باقیمانده انجام شود.
-
انکوباسیون روی یخ: سلولها بهمدت ۳۰ دقیقه تا ۲ ساعت روی یخ انکوبه میشوند تا یونهای Ca²⁺ فرصت تعامل با غشای سلولی را داشته باشند.
-
آلیکوت و ذخیرهسازی: سلولها به حجمهای کوچک تقسیم شده و یا بلافاصله استفاده میشوند یا با ۱۵٪ گلیسرول در دمای –۸۰°C ذخیره میشوند.
-
مرحله ترنسفورمیشن: DNA پلاسمیدی (معمولاً ۱–۱۰ نانوگرم) به سلولهای کامپتنت اضافه شده و بهمدت ۱۵–۳۰ دقیقه روی یخ انکوبه میشود. سپس شوک حرارتی داده شده و در محیط غیرانتخابی (مانند SOC یا LB) بهمدت ۳۰–۶۰ دقیقه انکوبه میشود تا ژن مقاومت به آنتیبیوتیک بیان شود.
-
انتخاب: سلولها روی محیط آگار حاوی آنتیبیوتیک پلیت میشوند تا ترنسفورمانتها انتخاب شوند.
3.3 عوامل مؤثر بر بازده ترنسفورمیشن
بازده ترنسفورمیشن شیمیایی به عوامل متعددی بستگی دارد:
-
اندازه پلاسمید: پلاسمیدهای کوچکتر (کمتر از ۱۰ kb) معمولاً کارایی بالاتری دارند.
-
خلوص DNA: آلودگی با نمک یا فنل میتواند مانع جذب DNA شود.
-
سوش باکتری: سوشهایی مانند DH5α و TOP10 برای ترنسفورمیشن بهینه طراحی شدهاند.
-
مدت شوک حرارتی: بهینهسازی مدت شوک حرارتی بسیار مهم است؛ شوک طولانی ممکن است سلولها را از بین ببرد.
IV. الکتروپوریشن: روش با کارایی بالا برای انتقال DNA
4.1 اصل الکتروپوریشن
الکتروپوریشن روشی فیزیکی است که با استفاده از پالسهای ولتاژ بالا بهمدت کوتاه، لایه فسفولیپیدی غشای سلولی را موقتاً مختل کرده و منافذی در آن ایجاد میکند که DNA میتواند از آن عبور کند. برخلاف روش شیمیایی که وابسته به تعاملات یونی است، الکتروپوریشن مستقیماً DNA را با انرژی الکتریکی وارد سلول میکند.
4.2 آمادهسازی سلولهای الکتروکامپتنت
آمادهسازی سلولهای الکتروکامپتنت نیازمند حذف کامل یونها است؛ زیرا وجود نمک در هنگام پالس الکتریکی میتواند موجب جرقه (arcing) شود که سلولها را از بین میبرد.
-
رشد تا فاز لگاریتمی: سلولها تا OD₆₀₀ ~ ۰.۵ در LB یا محیط مناسب دیگر رشد داده میشوند.
-
شستوشو با آب دیونیزه: سلولها جمعآوری و چندین بار با آب دیونیزه سرد یا گلیسرول ۱۰٪ شسته میشوند تا یونها حذف شوند.
-
بازتعلیق نهایی: سلولها در حجم کمی از گلیسرول ۱۰٪ سرد بازتعلیق شده، تقسیمبندی و در –۸۰°C ذخیره میشوند.
-
پروتکل الکتروپوریشن: در مرحله ترنسفورمیشن، DNA به ۵۰ میکرولیتر سلول اضافه شده و در کووت الکتروپوریشن پیشسرد قرار میگیرد. پالس (مثلاً 1.8 kV، 25 μF، 200 اهم برای E. coli) اعمال میشود و بلافاصله محیط بازیابی اضافه میشود تا غشا ترمیم یابد.
4.3 مزایا و کاربردها
الکتروپوریشن دارای مزایای متعددی نسبت به روش شیمیایی است:
-
بازده بسیار بالا: تا 10⁹ ترنسفورمانت در ازای هر میکروگرم DNA.
-
قابلیت پذیرش پلاسمیدهای بزرگ: تا اندازه ۱۰۰ kb.
-
محدوده میزبان گستردهتر: مناسب برای باکتریهای گرم مثبت، آرکئا و حتی سلولهای یوکاریوتی.
این روش بهویژه در زیستشناسی سنتزی کاربرد گستردهای دارد، جایی که انتقال سازههای ژنی بزرگ و دقیق مورد نیاز است.
V. بازیابی و انتخاب پس از ترنسفورمیشن
پس از ترنسفورمیشن، سلولهای باکتریایی نیاز به زمان برای بازیابی و بیان ژن مقاومت دارند. این مرحله بهویژه برای سلولهای الکتروپور شده که غشای آنها شدیداً تخریب شده، حیاتی است.
بازیابی معمولاً در محیط SOC یا LB در دمای ۳۷°C با شیکر برای ۴۵–۶۰ دقیقه انجام میشود. محیط SOC بهدلیل ترکیب غنی و توان بافری بالا اغلب ترجیح داده میشود.
سپس انتخاب روی محیط جامد آگار حاوی آنتیبیوتیک مناسب انجام میشود. فقط سلولهایی که پلاسمید را دریافت کرده و حفظ کردهاند قادر به رشد و تشکیل کلونی خواهند بود.
VI. رفع اشکال و بهینهسازی
با وجود سادگی ظاهری پروتکلهای ترنسفورمیشن، مشکلاتی بهوفور رخ میدهند. برخی مشکلات رایج عبارتاند از:
-
بازده پایین ترنسفورمیشن: ممکن است ناشی از آمادهسازی نامناسب سلول، کیفیت پایین DNA یا شرایط نادرست شوک حرارتی یا الکتروپوریشن باشد.
-
عدم تشکیل کلونی: ممکن است بهدلیل عدم وجود ژن مقاومت، شوک حرارتی بیش از حد یا مرگ سلولی باشد.
-
تشکیل کلونیهای ماهوارهای: در صورتی رخ میدهد که آنتیبیوتیکها تجزیه شده باشند و سلولهای غیرترنسفورمانت در نزدیکی کلونیهای واقعی رشد کنند.
بهینهسازی شامل تنظیم دقیق هر مرحله، استفاده از معرفهای تازه و اطمینان از خلوص و غلظت مناسب DNA پلاسمیدی است.
انتخاب سلولهای ترنسفورم شده و شناسایی ریکامبینانتها
مهندسی ژنتیک، که یکی از ابزارهای بنیادی زیستفناوری مدرن محسوب میشود، اغلب بر موفقیت وارد کردن DNA خارجی به داخل یک موجود میزبان تکیه دارد. فرایند وارد کردن چنین DNA به داخل سلول، ترنسفورماسیون نامیده میشود و ستون فقرات کلونینگ مولکولی است. اما صرفاً وارد کردن DNA به سلول میزبان کافی نیست. در هر آزمایش ترنسفورماسیون، تنها بخش کوچکی از سلولها واقعاً DNA ریکامبینانت را دریافت و درون خود جای میدهند. بنابراین شناسایی و جدا کردن این سلولهای ترنسفورم شده امری ضروری است. اینجا است که استراتژیهای انتخاب و غربالگری اهمیت پیدا میکند.
این مقاله به بررسی اصول پایه و پیشرفته انتخاب سلولهای ترنسفورم شده میپردازد و تمرکز ویژهای روی شناسایی کلونهای ریکامبینانت دارد؛ بهویژه با استفاده از دو ابزار مهم مولکولی: سیستم پلاسمید pBR322 که بر اساس غیر فعال کردن ژن مقاومت به آنتیبیوتیک عمل میکند و سیستم غیر فعال سازی ژن lacZ که پایه و اساس غربالگری آبی-سفید است.
ضرورت انتخاب سلولهای ترنسفورم شده
ترنسفورماسیون، به ویژه در سیستمهای پروکاریوتی مانند اشریشیا کلی، فرایندی نسبتاً ناکارآمد است. در یک فرایند استاندارد ترنسفورماسیون معمولاً یک جمعیت مختلط از سلولها ایجاد میشود: برخی هیچ پلاسمیدی دریافت نکردهاند (سلولهای غیر ترنسفورم شده)، برخی پلاسمید دریافت کردهاند ولی فاقد قطعه DNA خارجی هستند (سلولهای ترنسفورم شده ولی غیر ریکامبینانت) و بخش کوچکی پلاسمید ریکامبینانت دریافت کردهاند (سلولهای ترنسفورم شده ریکامبینانت). بدون یک مکانیزم برای تمایز این گروهها، مراحل بعدی در دستکاری ژنتیکی یا بیان پروتئین غیر قابل اعتماد و ناکارآمد خواهد بود.
بنابراین، دو وظیفه کلیدی پس از ترنسفورماسیون باید انجام شود:
-
انتخاب (Selection): تشخیص سلولهایی که هر نوع پلاسمید را دریافت کردهاند از سلولهایی که پلاسمید دریافت نکردهاند.
-
غربالگری (Screening): تمایز سلولهای حاوی پلاسمیدهای ریکامبینانت (دارای قطعه DNA دلخواه) از سلولهای حاوی پلاسمیدهای غیر ریکامبینانت (فاقد قطعه DNA خارجی).
انتخاب آنتیبیوتیکی: شناسایی سلولهای ترنسفورم شده
اکثر وکتورهای کلونینگ، از جمله پلاسمیدهای pBR322 و pUC، به گونهای طراحی شدهاند که حامل ژنهای نشانگر انتخابی (Selectable Marker Genes) هستند که معمولاً مقاومت در برابر آنتیبیوتیکها را کد میکنند. این ویژگی اجازه میدهد تا سلولهای ترنسفورم شده به راحتی بر اساس رشد در محیط حاوی آنتیبیوتیک شناسایی شوند.
برای مثال، اگر پلاسمید حامل ژن مقاومت به آنتیبیوتیک آنتیبیوتیک آمپیسیلین (amp^r) باشد، تنها سلولهای اشریشیا کلی که پلاسمید را دریافت کردهاند قادر به زنده ماندن و رشد در محیط حاوی آمپیسیلین خواهند بود. سلولهای غیر ترنسفورم شده که فاقد این ژن مقاومت هستند، در حضور آنتیبیوتیک نمیتوانند رشد کنند.
با این حال، این نوع انتخاب قادر به تمایز بین پلاسمیدهایی که قطعه DNA خارجی را دارند و آنهایی که ندارند نیست. برای این منظور، استراتژیهای دقیقتری مورد نیاز است.
شناسایی ریکامبینانتها
زمانی که وجود ترنسفورماسیون با استفاده از انتخاب آنتیبیوتیکی تأیید شد، گام بعدی تعیین این است که کدام سلولهای ترنسفورم شده حامل پلاسمید ریکامبینانت هستند؛ یعنی پلاسمیدی که قطعه DNA مورد نظر در آن به طور موفق وارد شده است. این کار معمولاً با استفاده از روش غیر فعال کردن درونگذاری (Insertional Inactivation) یک ژن گزارشگر یا ژن نشانگر انتخابی انجام میشود.
دو سیستم رایج عبارتند از:
-
غیر فعال کردن ژنهای مقاومت به آنتیبیوتیک (همانند سیستم pBR322)
-
غیر فعال کردن ژن lacZ (غربالگری آبی-سفید)
هر کدام از این سیستمها بر اساس این اصل عمل میکنند که با وارد کردن قطعه DNA خارجی به داخل یک ژن عملکردی، آن ژن دچار اختلال و غیر فعال میشود و این غیر فعال شدن از طریق صفات فنوتیپی قابل تشخیص است.
انتخاب ریکامبینانتها از طریق غیر فعال کردن ژن مقاومت به آنتیبیوتیک در پلاسمید pBR322
پلاسمید pBR322
پلاسمید pBR322 یکی از وکتورهای کلاسیک و پرکاربرد در زیستشناسی مولکولی است. این پلاسمید دو ژن مقاومت به آنتیبیوتیک دارد:
-
amp^r (مقاومت به آمپیسیلین)
-
tet^r (مقاومت به تتراسایکلین)
علاوه بر این، پلاسمید حاوی چندین سایت محدودکننده منحصر به فرد است که برای وارد کردن DNA خارجی استفاده میشوند. برخی از این سایتها در داخل توالیهای کدکننده ژنهای مقاومت قرار دارند.
برای مثال:
-
سایت BamHI در داخل ژن tet^r واقع شده است.
-
سایتهای PstI و PvuI در داخل ژن amp^r واقع شدهاند.
مکانیسم غیر فعالسازی با استفاده از درونگذاری در pBR322
وقتی یک قطعه DNA خارجی در سایت محدودکنندهای که داخل ژن مقاومت به آنتیبیوتیک قرار دارد وارد میشود، این درونگذاری باعث قطع خوانش یا تخریب توالی ژن شده و آن ژن را غیر فعال میکند. این موضوع اساس غربالگری ریکامبینانتها است.
فرض کنیم DNA خارجی در سایت BamHI واقع در ژن tet^r وارد شده باشد:
-
سلولهایی که پلاسمید pBR322 غیر ریکامبینانت دارند (بدون وارد شدن DNA خارجی) هر دو ژن amp^r و tet^r سالم و عملکردی دارند. بنابراین این سلولها در حضور هر دو آنتیبیوتیک آمپیسیلین و تتراسایکلین رشد میکنند.
-
سلولهایی که پلاسمید pBR322 ریکامبینانت دارند (با درونگذاری DNA خارجی در سایت BamHI در ژن tet^r) ژن tet^r غیر فعال شده است اما ژن amp^r هنوز سالم است. بنابراین این سلولها تنها نسبت به آمپیسیلین مقاوم هستند ولی نسبت به تتراسایکلین حساساند.
روش کار به این صورت است که ابتدا سلولهای ترنسفورم شده روی محیط آگار حاوی آمپیسیلین کشت داده میشوند تا همه سلولهایی که پلاسمید را دریافت کردهاند انتخاب شوند. سپس کلونیهای رشد یافته روی این پلیتها به روش replica plating (کپی برداری روی محیطهای جدید) روی محیط حاوی تتراسایکلین منتقل میشوند.
نتایج ممکن:
-
کلونیهایی که هم روی محیطهای آمپیسیلین و هم تتراسایکلین رشد میکنند: پلاسمید غیر ریکامبینانت دارند.
-
کلونیهایی که تنها روی محیط آمپیسیلین رشد میکنند و روی تتراسایکلین رشد نمیکنند: پلاسمید ریکامبینانت دارند.
این استراتژی به خوبی کلونیهای ریکامبینانت را بر اساس تغییر پروفایل مقاومت آنتیبیوتیکی که ناشی از غیر فعال شدن ژن مقاومت است، شناسایی میکند.
محدودیتها
-
این روش شامل دو مرحله انتخاب است که به ویژه مرحله replica plating زمانبر و نیازمند کار بیشتر است.
-
احتمال بروز نتایج مثبت کاذب وجود دارد، مثلاً به دلیل غیر فعال شدن خود به خودی ژن مقاومت.
-
گاهی اوقات در محیط آنتیبیوتیکی کلونیهای کوچک و غیر واقعی (Satellite Colonies) تشکیل میشوند که میتوانند باعث اشتباه شوند.
با این وجود، استراتژی استفاده از مقاومت دوگانه آنتیبیوتیکی در pBR322 یکی از روشهای تاریخی و آموزشی مهم در زیستشناسی مولکولی است.
انتخاب ریکامبینانتها از طریق غیر فعال کردن ژن lacZ (غربالگری آبی-سفید)
ژن lacZ و مکملاسیون α
یکی دیگر از روشهای بسیار پرکاربرد شناسایی پلاسمیدهای ریکامبینانت بر پایه ژن lacZ است که آنزیم β-گالاکتوزیداز را کد میکند. این روش از پدیدهای به نام مکملاسیون α بهره میبرد.
در این سیستم، سلولهای میزبان اشریشیا کلی (مانند سویههای DH5α یا JM109) دارای یک ژن lacZ ناقص (مخصوصاً قطعه Ω که بخش N-ترمینال را ندارد) هستند و به تنهایی قادر به تولید β-گالاکتوزیداز فعال نیستند.
وکتورهای پلاسمیدی مانند pUC18 و pUC19 حاوی ژن lacZα هستند که بخش N-ترمینال α-پپتید را کد میکند. وقتی چنین پلاسمیدی وارد سلول میزبان شود، این α-پپتید ناقص (lacZα) با بخش ناقص ژن lacZ موجود در کروموزوم میزبان مکمل میشود و β-گالاکتوزیداز فعال تشکیل میشود. این پدیده مکملاسیون α نامیده میشود.
استفاده از X-gal به عنوان سوبسترا
برای مشاهده فعالیت β-گالاکتوزیداز، سوبسترا X-gal (۵-برومو-۴-کلرو-۳-ایندولیل β-D-گالاکتوپیرانوزید) در محیط آگار اضافه میشود. وقتی این ماده توسط β-گالاکتوزیداز شکسته شود، ترکیبی آبیرنگ تولید میکند. بنابراین کلونیهایی که β-گالاکتوزیداز فعال دارند، آبی رنگ دیده میشوند و آنهایی که فاقد آنزیم هستند سفید باقی میمانند.
شناسایی ریکامبینانتها
در وکتورهایی مانند pUC19، چندین سایت محدودکننده (MCS) به گونهای طراحی شدهاند که درون ژن lacZα قرار دارند. وقتی DNA خارجی در این MCS وارد میشود، توالی کدکننده lacZα مختل میشود و پپتید α تولید نمیشود. این منجر به از دست رفتن مکملاسیون α و عدم فعالیت β-گالاکتوزیداز میشود.
بنابراین:
-
کلونیهای غیر ریکامبینانت (lacZα سالم): در حضور X-gal و اینداکتور IPTG آبی رنگ هستند.
-
کلونیهای ریکامبینانت (lacZα مختل شده): سفید رنگ هستند.
برای افزایش کارایی این روش، محیط کشت حاوی:
-
X-gal: سوبسترا برای β-گالاکتوزیداز
-
IPTG (ایزوبوتیل-β-D-1-تیوگالاکتوپیرانوزید): یک اینداکتور غیر متابولیزه شونده که باعث فعال شدن اپرون lac میشود.
مزایای غربالگری آبی-سفید
-
یک روش بصری، سریع و تک مرحلهای است که نیاز به replica plating را از بین میبرد.
-
برای غربالگریهای پرتعداد بسیار کارآمد و آسان است.
-
تنها به انتخاب اولیه با آنتیبیوتیک نیاز دارد و پس از آن میتوان کلونیهای ریکامبینانت را از طریق رنگ متمایز کرد.
محدودیتها
-
بعضی کلونیهای سفید ممکن است حاوی پلاسمیدهای فاقد قطعه DNA خارجی یا وکتورهای خود به خود بسته شده باشند که به صورت تصادفی lacZα را مختل کردهاند.
-
کلونیهای آبی گاهی ممکن است رنگ کمرنگ یا ناپایدار داشته باشند به علت مکملاسیون ناقص.
-
برخی سویههای میزبان ممکن است فعالیت پسزمینه β-گالاکتوزیداز داشته باشند.
با وجود این محدودیتها، غربالگری آبی-سفید یکی از قدرتمندترین و پرکاربردترین روشها برای شناسایی پلاسمیدهای ریکامبینانت در کلونینگ مولکولی به شمار میرود.
تغییر ژنتیکی (ترنسفورماسیون) یکی از پایههای اصلی زیستشناسی مولکولی مدرن، بیوتکنولوژی و تحقیقات زیستپزشکی است. در حالی که روشهای ترنسفورماسیون باکتریایی به دلیل سادگی نسبی و کارایی بالا به طور گسترده توسعه یافته و بهینه شدهاند، وارد کردن ماده ژنتیکی به سلولهای غیر باکتریایی—از جمله سلولهای یوکاریوتی مانند سلولهای پستانداران، گیاهان، قارچها یا پروتوزوآها—چالشهای خاصی دارد و نیازمند روشهای تخصصی است. همچنین، ترنسفورماسیون سلولهای تک، چه باکتریایی، یوکاریوتی یا سایر انواع سلولها، نیازمند تکنیکهای دقیق و اغلب بسیار کنترل شده است تا بتوان ماده ژنتیکی یا سایر ماکرومولکولها را وارد و به شکل پایدار در سلول بیان کرد.
در کنار فناوریهای ترنسفورماسیون، واکنش زنجیرهای پلیمراز (PCR) به عنوان یک تکنیک انقلابی مولکولی برجسته است که امکان تکثیر انتخابی توالیهای DNA خاص را از مقدار بسیار کم نمونه اولیه فراهم میکند. PCR نه تنها در فرایندهای کلونینگ و ترنسفورماسیون کاربرد دارد، بلکه در تشخیص پزشکی، علوم قضایی و مطالعات تکاملی نیز بسیار حیاتی است.
این مقاله هدف دارد تا به بررسی مفصل اصول، روشها، چالشها و کاربردهای مرتبط با ترنسفورماسیون سلولهای غیر باکتریایی و سلولهای تک، همچنین مرور جامع PCR، شامل مکانیزم، انواع مختلف و نقش کلیدی آن در زیستشناسی مولکولی بپردازد.
بخش اول: ترنسفورماسیون سلولهای غیر باکتریایی
برخلاف سلولهای باکتریایی که معماری سلولی سادهتری دارند و معمولاً فاقد غشای هستهای هستند، سلولهای غیر باکتریایی—که عمدتاً یوکاریوتی هستند—دارای ساختارهای درونسلولی پیچیده و اسکلت سلولی مقاومی میباشند. این پیچیدگی، فرایند وارد کردن ماده ژنتیکی خارجی به داخل این سلولها را دشوار میکند. وارد کردن DNA خارجی برای مطالعات بیان ژن، درمان ژنی، تولید پروتئینهای بازکشت شده (ریکامبینانت) و توسعه ارگانیسمهای اصلاحشده ژنتیکی (GMO) ضروری است.
سلولهای غیر باکتریایی طیف وسیعی از موجودات را شامل میشوند، از جمله سلولهای پستانداران (مانند خطوط سلولی انسان و موش)، سلولهای گیاهی، قارچها و پروتوزوآهای مختلف. هر نوع سلول موانع منحصر به فردی دارد و نیازمند پروتکلهای خاص ترنسفورماسیون است.
چالشها در ترنسفورماسیون سلولهای غیر باکتریایی
-
غشای سلولی و دیواره سلولی: سلولهای یوکاریوتی توسط یک غشای دو لایه لیپیدی پوشیده شدهاند که دارای پروتئینهایی است و در برابر ورود ماکرومولکولهای خارجی بسیار گزینشی و محافظتکننده عمل میکند. سلولهای گیاهی و قارچها همچنین دارای دیواره سلولی سختی از جنس سلولز یا کیتین هستند که به عنوان مانع فیزیکی اضافی عمل میکند.
-
غشای هستهای: بر خلاف باکتریها که DNA پلاسمیدی میتواند به طور موقت در سیتوپلاسم عملکرد داشته باشد، در یوکاریوتها بیان ژن نیازمند ورود DNA به داخل هسته است. غشای هستهای به ویژه در سلولهای غیر تقسیم شونده که روزنههای هستهای گزینشی دارند، مانع مهمی محسوب میشود.
-
تجزیه درونسلولی: DNA وارد شده ممکن است توسط نوکلئازها (آنزیمهای تجزیهکننده DNA) در سیتوپلاسم پیش از رسیدن به هسته تخریب شود که باعث کاهش راندمان ترنسفورماسیون میشود.
-
ادغام و بیان ژن: ترنسفورماسیون پایدار نیازمند ادغام DNA به ژنوم یا حفظ آن به صورت اپیزوم (DNA خارج از کروموزوم) است. همچنین ژنهای خارجی معمولاً نیازمند عناصر تنظیمی سازگار با ماشینهای رونویسی و ترجمه میزبان هستند.
روشهای ترنسفورماسیون سلولهای غیر باکتریایی
روشهای متعددی برای غلبه بر این موانع توسعه یافتهاند که عمدتاً به سه دسته فیزیکی، شیمیایی و بیولوژیکی تقسیم میشوند.
-
روشهای فیزیکی
-
الکتروپوراسیون: استفاده از پالسهای الکتریکی کوتاه و با ولتاژ بالا که باعث ایجاد گذرگاههای موقت در غشای سلول میشود و DNA را وارد سلول میکند. پارامترهای الکتروپوراسیون باید برای هر نوع سلول به دقت بهینه شود تا راندمان ترنسفورماسیون افزایش و میزان مرگ سلولی کاهش یابد.
-
میکرواینجکشن: با استفاده از میکروپیپتهای شیشهای بسیار نازک زیر میکروسکوپ، DNA به طور مستقیم به سیتوپلاسم یا هسته تزریق میشود. این روش بسیار دقیق و کارآمد است اما نیازمند کار دستی زیاد بوده و معمولاً برای ترنسفورماسیون سلولهای تک مانند اووسیتها و زیگوتها کاربرد دارد.
-
سلاح ژنی (بیولستیک): ذرات بسیار ریز طلا یا تنگستن پوشیده شده با DNA توسط فشار بالا به داخل سلولها پرتاب میشوند تا DNA را وارد کنند. این روش به ویژه در ترنسفورماسیون سلولهای گیاهی محبوب است.
-
ترنسفورماسیون با لیزر: پالسهای لیزری بسیار سریع گذرگاههای موقت در غشای سلول ایجاد میکنند و اجازه ورود DNA را میدهند. این روش بسیار کنترلشده است و برای سلولهای حساس یا نادر مناسب است.
-
روشهای شیمیایی
-
رسوب کلسیم فسفات: این روش کلاسیک شامل ایجاد رسوب DNA و کلسیم فسفات است که به سطح سلول چسبیده و باعث ورود DNA میشود، به ویژه در سلولهای پستاندار.
-
لیپوفکشن (ترانسفکشن با لیپید): لیپوزومها یا نانوذرات لیپیدی DNA را در بر میگیرند و با غشای سلول ترکیب شده و محموله خود را آزاد میکنند. این روش کارآمد و به طور گسترده برای ترنسفورماسیون موقت و پایدار استفاده میشود.
-
پلیاتیلنایمین (PEI) و سایر پلیمرها: پلیمرهای با بار مثبت DNA را متراکم میکنند و از طریق اندوسیتوز وارد سلول میشوند.
-
روشهای بیولوژیکی
-
بردارهای ویروسی: ویروسها به طور طبیعی برای وارد کردن ماده ژنتیکی به سلول میزبان تکامل یافتهاند. ویروسهای مهندسی شده (مانند آدنوویروسها، لنتیویروسها، رتروویروسها) برای انتقال ژنهای خارجی بدون ایجاد بیماری استفاده میشوند که راندمان ترنسفورماسیون بالا و ادغام پایدار فراهم میکنند.
-
ترنسفورماسیون توسط آگروباکتریوم: این باکتری به طور خاص در گیاهان به کار میرود و بخشی از پلاسمید Ti خود (T-DNA) را وارد ژنوم گیاه میکند که موجب اصلاح ژنتیکی پایدار میشود.
کاربردهای ترنسفورماسیون سلولهای غیر باکتریایی
-
مطالعات عملکرد ژن: معرفی ژنهای طبیعی یا موتانت برای بررسی نقش آنها.
-
تولید پروتئین: تولید پروتئینهای بازترکیب مانند آنتیبادیهای مونوکلونال در سلولهای پستاندار.
-
درمان ژنی: اصلاح نقصهای ژنتیکی با وارد کردن ژنهای عملکردی به سلولهای بیمار.
-
تولید ارگانیسمهای تراریخته: گیاهان و حیوانات اصلاحشده برای اهداف تحقیق، کشاورزی یا درمانی.
بخش دوم: ترنسفورماسیون سلولهای تک
اهمیت و زمینه
ترنسفورماسیون سلولهای تک به معنای اصلاح ژنتیکی یک سلول منفرد به جای جمعیت سلولی است. این سطح دقت برای کاربردهایی مانند کلونینگ حیوانات از طریق انتقال هسته سلولهای سوماتیک، ایجاد خطوط سلولی یکسان ژنتیکی، مطالعه ناهمگنی سلولی و پیشرفتهای زیستشناسی سنتزی ضروری است.
تکنیکها و چالشها
چالش اصلی در ترنسفورماسیون سلولهای تک، دستیابی به ورود کارآمد DNA با حداقل آسیب سلولی و همچنین جداسازی و تکثیر سلولهای ترنسفورمه شده است.
-
میکرواینجکشن: تزریق مستقیم DNA به سلولهای تک مانند اووسیتها و زیگوتها.
-
الکتروپوراسیون سلول تک: استفاده از دستگاههای میکروفلوئیدیک یا محفظههای الکتروپوراسیون تخصصی برای هدف قرار دادن سلولهای منفرد.
-
عفونت با بردار ویروسی: استفاده از غلظتهای کنترلشده ویروس و مرتبسازی سلولی برای عفونت سلولهای منفرد.
-
تحویل لیپوزومی: استفاده از میکروپیپت برای ورود لیپوزومها به سلولهای منفرد.
کلونینگ و انتخاب سلولهای تک
پس از ترنسفورماسیون، سلولهای منفرد معمولاً به طور جداگانه با روشهایی مانند رقت محدود، میکروفلوئیدیک یا سیتومتری جریان کشت داده میشوند تا کلونهای بازترکیب را انتخاب و تکثیر کنند. سپس این کلونها از نظر ژنتیکی و فنوتیپی مورد بررسی قرار میگیرند.
بخش سوم: واکنش زنجیرهای پلیمراز (PCR)
مقدمه و پسزمینه تاریخی
PCR که در سال ۱۹۸۳ توسط کری مولیس توسعه یافت، با امکان تکثیر نمایی توالیهای خاص DNA از مقدار بسیار کم نمونه، زیستشناسی مولکولی را متحول کرد. این روش میتواند در عرض چند ساعت میلیاردها نسخه DNA تولید کند.
اصول و اجزای PCR
PCR همانندسازی DNA را به صورت آزمایشگاهی شبیهسازی میکند و شامل چرخههای حرارتی برای دناتوره شدن DNA، اتصال پرایمرها و سنتز رشتههای جدید است.
اجزای کلیدی عبارتند از:
-
DNA الگو: DNA حاوی توالی هدف.
-
پرایمرها: الیگونوکلئوتیدهای کوتاه سنتزی که به انتهای ۳’ توالی هدف متصل میشوند؛ پرایمرهای رو به جلو و عقب ناحیه هدف را مشخص میکنند.
-
پلیمراز DNA: آنزیم مقاوم به حرارت (مانند Taq پلیمراز) که رشتههای جدید DNA را سنتز میکند.
-
dNTPها: نوکلئوتیدهای سازنده DNA (dATP, dTTP, dGTP, dCTP).
-
بافر و Mg2+: محیط یونی بهینه و کاتیونهای لازم برای فعالیت آنزیمی.
مراحل چرخه PCR
-
دناتوره شدن (۹۴–۹۸ درجه سانتیگراد): دو رشته DNA از هم جدا میشوند.
-
اتصال پرایمرها (۵۰–۶۵ درجه سانتیگراد): پرایمرها به توالیهای مکمل روی الگو متصل میشوند.
-
تکثیر (۷۲ درجه سانتیگراد): پلیمراز DNA پرایمرها را ادامه داده و رشتههای جدید DNA میسازد.
هر چرخه تعداد مولکولهای DNA را دو برابر میکند و منجر به تکثیر نمایی میشود.
انواع و واریاسیونهای PCR
-
PCR معمولی: تشخیص نهایی محصول با الکتروفورز ژل.
-
PCR در زمان واقعی (qPCR): رصد همزمان تکثیر با استفاده از رنگها یا پروبهای فلورسانت برای اندازهگیری کمی DNA.
-
RT-PCR: تبدیل RNA به cDNA قبل از PCR، برای مطالعه بیان ژن.
-
Multiplex PCR: تکثیر همزمان چند هدف با چند جفت پرایمر.
-
Nested PCR: استفاده از دو مجموعه پرایمر در دو واکنش متوالی برای افزایش دقت.
-
Digital PCR: تقسیم واکنش به هزاران حجم نانولیتر برای تعیین دقیق مقدار DNA.
کاربردهای PCR
-
کلونینگ: تکثیر توالیهای DNA هدف برای وارد کردن به وکتورها.
-
تشخیص: شناسایی پاتوژنها، جهشها یا بیماریهای ژنتیکی.
-
پزشکی قانونی: اثر انگشت DNA و شناسایی افراد.
-
زیستشناسی تکاملی: مطالعه تنوع ژنتیکی و فیلوژنتیک.
-
آنالیز بیان ژن: اندازهگیری سطح mRNA.
کلونینگ سلولهای بنیادی
انتقال هستهٔ سلول سوماتیک (SCNT) که با عنوان عمومی «کلونسازی سلولهای بنیادی» شناخته میشود، میتواند برای تولید جنینهایی با هدف پژوهشی یا درمانی بهکار رود. در این نوع کلونسازی که «کلونسازی تحقیقاتی» یا «کلونسازی درمانی» نیز نامیده میشود، هدف تولید انسان کلونشده نیست، بلکه برداشت سلولهای بنیادی از جنین برای بررسی رشد انسان و درمان بیماریهاست. اگرچه یک بلاستوسیست انسانی کلونشده تاکنون ایجاد شده، اما هنوز هیچ رده سلولی بنیادی از منبع کلونشده بهدست نیامده است.
فرآیند کلونسازی درمانی از طریق ساخت سلولهای بنیادی جنینی با هدف درمان بیماریهایی مانند دیابت و آلزایمر انجام میشود. این فرآیند با خارج کردن هستهٔ دارای DNA از یک سلول تخمک و جایگزینی آن با هستهٔ سلول بزرگسال آغاز میشود. مثلاً در مورد بیماری آلزایمر، هستهٔ سلول پوستی بیمار به تخمک خالی منتقل میشود. تخمک با هستهٔ جدید واکنش نشان میدهد و شروع به رشد میکند و به جنینی بدل میشود که از نظر ژنتیکی با فرد بیمار یکسان است. سپس این جنین تبدیل به بلاستوسیست میشود که توانایی تبدیل به هر نوع سلول در بدن را دارد.
مزیت SCNT در کلونسازی این است که سلولهای سوماتیک بهراحتی قابل استخراج و کشت در آزمایشگاه هستند. این فرآیند میتواند ژنوم خاصی را به دام بیندازد یا حذف کند، بهویژه در حیوانات کشاورزی. نکتهٔ کلیدی آن است که در این روش، تخمک بدون استفاده از اسپرم، عملکرد طبیعی خود را حفظ میکند و بهجای آن، هستهٔ سلول سوماتیک در آن قرار میگیرد و تخمک با آن مانند هستهٔ اسپرم رفتار میکند.
مراحل کلونسازی حیوان مزرعهای با استفاده از SCNT تقریباً برای تمام گونهها مشابه است. ابتدا سلولهای سوماتیک از حیوان اهداکنندهٔ DNA جمعآوری میشود. این سلولها ممکن است بلافاصله استفاده شوند یا برای استفادهٔ بعدی ذخیره شوند. سختترین بخش SCNT، حذف DNA مادری از تخمک در مرحلهٔ متافاز II است. پس از آن، هستهٔ سلول سوماتیک به سیتوپلاسم تخمک منتقل میشود و یک جنین تکسلولی ایجاد میکند. سلول حاصل از ترکیب تخمک و سلول سوماتیک سپس در معرض جریان الکتریکی قرار میگیرد تا توسعه جنین شروع شود. جنینهای موفق سپس در رحم جانوران جایگزین، مانند گاو یا گوسفند، قرار داده میشوند.
کاربردهای SCNT: این روش در کلونسازی حیوانات خوراکی مانند گوسفند، گاو، بز و خوک موفقیتآمیز بوده است. همچنین SCNT بهعنوان روشی برای نجات گونههای در خطر انقراض مطرح شده است. با این حال، فشارهایی که بر تخمک و هستهٔ سلول وارد میشود، در مراحل اولیه پژوهشها باعث مرگ تعداد زیادی از سلولها میشد. مثلاً گوسفند دالی پس از استفاده از ۲۷۷ تخمک تولید شد که فقط ۲۹ جنین زنده حاصل شد، تنها ۳ عدد تا زمان تولد زنده ماندند، و فقط یکی به بزرگسالی رسید. از آنجا که این فرآیند نیاز به کار دستی زیر میکروسکوپ دارد، بسیار پرهزینه و پیچیده است. با این حال، تا سال ۲۰۱۴، دانشمندان به نرخ موفقیت ۷ تا ۸ مورد موفق از هر ۱۰ مورد دست یافتند و در سال ۲۰۱۶، شرکت کرهای Sooam Biotech گزارش کرد که روزانه ۵۰۰ جنین کلونشده تولید میکند.
نکته مهم: در روش SCNT، تمام اطلاعات ژنتیکی سلول اهداکننده منتقل نمیشود، زیرا میتوکندری سلول اهداکننده باقی نمیماند. بنابراین سلول نهایی، میتوکندریهای تخمک را حفظ میکند و به همین دلیل، کلونهایی مانند دالی، نسخهٔ کامل و دقیق اهداکنندهٔ هسته نیستند.