تقسیم سلولی
مقدمه: اهمیت تقسیم سلولی در زندگی و پزشکی
تقسیم سلولی یکی از بنیادیترین فرآیندهای زیستی است که در همه موجودات زنده از سادهترین باکتریها تا پیچیدهترین جانوران اتفاق میافتد. این فرآیند، اساس بقاء، رشد، تکثیر و بازسازی سلولها را تشکیل میدهد و بدون آن، زندگی به شکلی که میشناسیم امکانپذیر نخواهد بود. تقسیم سلولی نه تنها در حفظ تداوم نسل و رشد ارگانیزمها نقش کلیدی دارد، بلکه از جنبه پزشکی نیز اهمیت فراوانی برخوردار است.
در سطح سلولی، تقسیم سلولی به سلولها اجازه میدهد تا تعداد خود را افزایش دهند و سلولهای آسیبدیده یا فرسوده جایگزین شوند. در طول رشد جنینی، این فرآیند به طور دقیق و منظم سلولها را تکثیر میکند تا بافتها و اندامها شکل بگیرند. همچنین، تقسیم سلولی نقش مهمی در بازسازی بافتها پس از آسیبها یا زخمها ایفا میکند و به این ترتیب به حفظ سلامت بدن کمک میکند.
از سوی دیگر، اختلالات در روند طبیعی تقسیم سلولی میتواند منجر به بیماریهای جدی شود. سرطان، یکی از شناختهشدهترین بیماریهای مرتبط با تقسیم سلولی است که در آن سلولها کنترل خود را بر روی چرخه تقسیم از دست میدهند و به صورت غیرقابل کنترل شروع به تکثیر میکنند. این نکته اهمیت مطالعه دقیق و کامل فرآیندهای تقسیم سلولی و مکانیزمهای تنظیم آن را در حوزه پزشکی و زیستشناسی افزایش میدهد.
درک بهتر مراحل مختلف تقسیم سلولی، از جمله میتوز و میوز، و نحوه تنظیم چرخه سلولی، به دانشمندان و پزشکان کمک میکند تا راهکارهای درمانی جدیدی برای بیماریهای مرتبط با تقسیم سلولی توسعه دهند. همچنین، این دانش میتواند در زمینههای متنوعی مانند زیستفناوری، تولید مثل مصنوعی و درمانهای بازسازی بافت مورد استفاده قرار گیرد.
در این مقاله، قصد داریم تا نگاهی جامع به فرآیندهای تقسیم سلولی داشته باشیم؛ از چرخه سلولی و تنظیم آن، تا مراحل دقیق میتوز و میوز و تفاوتهای اساسی بین این دو نوع تقسیم، همچنین ارتباط این فرآیندها با رشد طبیعی و بیماریهایی مانند سرطان. هدف این است که مخاطبان، چه متخصصان حوزه زیستشناسی و پزشکی و چه علاقهمندان به دانش زیستی، تصویری کامل و دقیق از این موضوع حیاتی داشته باشند و پاسخ تمام سوالات احتمالی خود را بیابند.
مفهوم تقسیم سلولی و انواع آن
تقسیم سلولی فرآیندی است که طی آن یک سلول مادر به دو یا چند سلول دختر تقسیم میشود. این فرآیند اساس تداوم حیات است و در تمامی ارگانیسمها نقش کلیدی در رشد، بازسازی بافتها و تولید مثل ایفا میکند. تقسیم سلولی تضمین میکند که اطلاعات ژنتیکی سلول مادر به درستی و به طور دقیق به سلولهای دختر منتقل شود، تا سلولهای جدید بتوانند عملکردهای خود را به درستی انجام دهند.
به طور کلی، تقسیم سلولی به دو دسته اصلی تقسیم میشود: میتوز و میوز.
- میتوز : نوعی تقسیم سلولی است که طی آن سلول مادر به دو سلول دختر کاملاً مشابه تقسیم میشود. این فرآیند در سلولهای سوماتیک (سلولهای بدن به جز سلولهای تولید مثلی) رخ میدهد و نقش اصلی آن در رشد، ترمیم و جایگزینی سلولهای آسیبدیده است. در میتوز، هر سلول دختر دارای تعداد کروموزومهای مشابه سلول مادر میباشد و بدین ترتیب اطلاعات ژنتیکی حفظ میشود.
- میوز : نوعی تقسیم سلولی تخصصی است که در سلولهای جنسی (گامتها) رخ میدهد. میوز منجر به تولید سلولهایی میشود که نصف تعداد کروموزومهای سلول مادر را دارند. این کاهش در تعداد کروموزومها باعث تنوع ژنتیکی و حفظ تعداد کروموزومها در نسلهای بعدی میشود و نقش بسیار مهمی در تولید مثل جنسی ایفا میکند.
علاوه بر این دو نوع اصلی، در برخی شرایط خاص تقسیم سلولی غیرمعمول یا ویژه نیز مشاهده میشود که شامل تقسیمهای نامتقارن، تقسیم بدون تقسیم هستهای و دیگر موارد است که در توسعه بافتها و پاسخهای سلولی نقش دارند.
چرخه سلولی که شامل مجموعهای از مراحل متوالی است، چارچوب زمانی و مکانیزمهای تنظیم تقسیم سلولی را فراهم میکند. این چرخه تعیین میکند که سلول کی و چگونه تقسیم شود و اطمینان حاصل میکند که هر مرحله به درستی انجام گیرد.
درک دقیق تقسیم سلولی و انواع آن، به ما کمک میکند تا بتوانیم فرایندهای زیستی پایه را بهتر بشناسیم و همچنین پایههای علمی درمان بیماریهای مرتبط با اختلالات تقسیم سلولی مانند سرطان را فراهم کنیم.
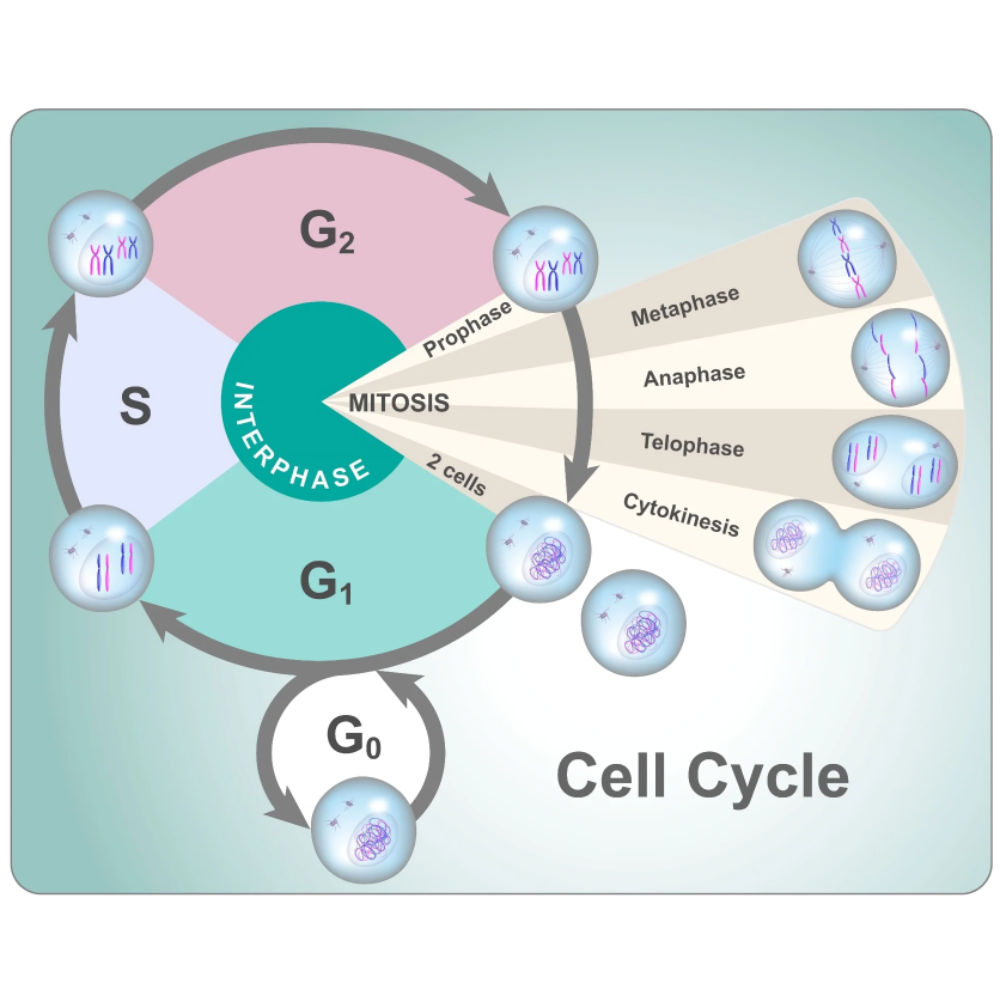
چرخه سلولی: مراحل، تنظیم و اهمیت آن در رشد طبیعی
چرخه سلولی مجموعهای منظم و هماهنگ از مراحل است که سلول برای تقسیم و تولید دو سلول دختر طی میکند. این چرخه نقش بسیار حیاتی در حفظ سلامت، رشد و بازسازی بافتها دارد. چرخه سلولی تضمین میکند که سلول قبل از تقسیم، تمامی مواد لازم و شرایط مناسبی برای انتقال درست اطلاعات ژنتیکی و تقسیم سلولی فراهم کرده باشد.
مراحل اصلی چرخه سلولی شامل چهار بخش اساسی است:
- مرحله : G1 (Gap 1) این مرحله پس از تقسیم سلولی شروع میشود و سلول در این مدت به رشد و فعالیتهای متابولیکی میپردازد. سلول در این مرحله اندازه خود را افزایش میدهد، پروتئینها و RNA مورد نیاز برای سنتز DNA را تولید میکند و آماده ورود به مرحله بعدی میشود.
- مرحله : S (Synthesis) در این مرحله، سلول DNA خود را به طور کامل تکثیر میکند. این مرحله حیاتی است زیرا باید اطلاعات ژنتیکی دقیق و بدون خطا دو برابر شود تا هر سلول دختر کروموزومهای کامل و یکسانی داشته باشد.
- مرحله : G2 (Gap 2) پس از تکثیر DNA، سلول وارد این مرحله میشود و به تکمیل ساخت پروتئینها و ارگانلها میپردازد تا برای فرآیند تقسیم سلولی آماده باشد. همچنین در این مرحله بررسیهای متعددی انجام میشود تا مطمئن شوند DNA به درستی تکثیر شده و آسیب ندیده است.
- مرحله M (Mitosis یا تقسیم سلولی) : در این مرحله، فرآیند واقعی تقسیم سلولی اتفاق میافتد که شامل تقسیم هسته (میتوز) و سپس تقسیم سیتوپلاسم (سیتوکینز) است. در این مرحله، سلول مادر به دو سلول دختر کاملاً مشابه تقسیم میشود.
بین این مراحل، نقاط کنترل یا Checkpoint هایی وجود دارد که اطمینان حاصل میکنند سلول تنها زمانی به مرحله بعدی وارد شود که تمامی شرایط لازم فراهم شده باشد. این نقاط کنترل به جلوگیری از تقسیم سلولی ناقص یا آسیبدیده کمک میکنند و نقش کلیدی در حفظ سلامت سلولی و جلوگیری از بیماریهایی مانند سرطان دارند.
تنظیم چرخه سلولی توسط مولکولهایی مانند سیکلینها و کینازهای وابسته به سیکلین (CDK) انجام میشود. این مولکولها با فعالیتهای متقابل و تنظیم دقیق، شروع و پایان هر مرحله از چرخه را کنترل میکنند. به عنوان مثال، افزایش یا کاهش سطح سیکلینها، فعال یا غیرفعال شدن CDK ها و سیگنالهای داخلی و خارجی سلول تعیینکننده ادامه یا توقف چرخه سلولی هستند.
از نظر اهمیت، چرخه سلولی نه تنها برای رشد طبیعی بدن ضروری است، بلکه نقش مهمی در ترمیم بافتها، حفظ تعادل سلولی و پاسخ به آسیبها دارد. اختلال در تنظیم چرخه سلولی میتواند منجر به تقسیم غیرقابل کنترل سلولها شود که پایه بروز سرطان و دیگر بیماریهای مرتبط با رشد سلولی است.
در نتیجه، مطالعه و فهم عمیق چرخه سلولی و تنظیم آن به عنوان یک ابزار کلیدی در علوم پزشکی و زیستشناسی مطرح است و به توسعه درمانهای هدفمند برای بیماریهای مختلف کمک میکند.
میتوز: تعریف و اهمیت
میتوز فرآیندی است که طی آن یک سلول مادر به دو سلول دختر با ساختار ژنتیکی کاملاً مشابه تقسیم میشود. این نوع تقسیم سلولی در سلولهای سوماتیک بدن انسان و سایر جانداران رخ میدهد و یکی از اساسیترین فرایندهای زیستی برای رشد، ترمیم بافتها، و حفظ ثبات ژنتیکی در موجودات زنده است.
اهمیت میتوز را میتوان در چند حوزه کلیدی خلاصه کرد:
- رشد و نمو: از مراحل جنینی تا بلوغ و بزرگسالی، تقسیم سلولی میتوزی به افزایش تعداد سلولها کمک میکند و ساختارهای بدن را شکل میدهد.
- بازسازی و ترمیم : پس از آسیب بافتی، میتوز امکان جایگزینی سلولهای آسیب دیده را فراهم میآورد، مانند ترمیم پوست پس از زخم یا بازسازی بافتهای داخلی.
- حفظ ثبات ژنتیکی : میتوز تضمین میکند که هر سلول دختر دارای همان تعداد و ساختار کروموزومها باشد که سلول مادر دارد. این ویژگی برای حفظ یکپارچگی اطلاعات ژنتیکی و عملکرد صحیح سلولها حیاتی است.
- تقسیم متقارن : در بسیاری از سلولها، میتوز منجر به تقسیم متقارن میشود، به طوری که دو سلول دختر کاملاً مشابه از نظر اندازه، شکل و عملکرد تولید میشوند.
- پیشگیری از بیماری : با کنترل دقیق میتوز و مکانیزمهای نظارتی آن، از تقسیم غیرقانونی سلولها جلوگیری میشود، که اگر دچار اختلال شود میتواند منجر به بروز سرطان شود.
در نهایت، میتوز به عنوان سنگ بنای ساختار سلولی در ارگانیسمهای چندسلولی و حفظ تعادل بین تقسیم و مرگ سلولی، یکی از حیاتیترین فرایندهای بیولوژیکی است.
مراحل میتوز: از پروفاز تا تلوفاز
میتوز فرآیندی پویا و منظم است که طی آن سلول مادر به دو سلول دختر با همان ساختار ژنتیکی تقسیم میشود. این فرآیند شامل چند مرحله مشخص است که هر یک نقش مهمی در اطمینان از توزیع صحیح کروموزومها دارند. در کل، میتوز به پنج مرحله اصلی تقسیم میشود: پروفاز، پرومتافاز، متافاز، آنافاز و تلوفاز.
پروفاز
در این مرحله، اولین تغییرات ساختاری قابل مشاهده در هسته سلول رخ میدهد. کروماتین (مواد ژنتیکی داخل هسته) شروع به متراکم شدن و تبدیل شدن به کروموزومهای قابل رؤیت میکند. هر کروموزوم شامل دو کروماتید خواهری است که به وسیله سانترومر به هم متصلاند. همچنین، سلول شروع به تشکیل دوک میتوزی میکند؛ این ساختار متشکل از میکروتوبولها است که نقش حیاتی در جدا کردن کروماتیدها ایفا میکند. غشای هسته نیز کمکم دچار تغییر میشود.
پرومتافاز
در این مرحله، غشای هسته به طور کامل ناپدید میشود و دوک میتوزی به کروموزومها متصل میشود. پروتئینهای خاصی به نام کینتوکور به سانترومر کروموزومها متصل میشوند و نقطه اتصال میکروتوبولهای دوک میتوزی به کروماتیدها را فراهم میکنند. این اتصال برای هدایت کروموزومها در مراحل بعدی ضروری است.
متافاز
در این مرحله، کروموزومها به خط استوا یا صفحه متافازی سلول هدایت میشوند و در یک ردیف منظم قرار میگیرند. این مرحله بسیار مهم است، زیرا قرار گرفتن دقیق کروموزومها در خط وسط سلول تضمین میکند که هر سلول دختر مقدار برابر و دقیقی از اطلاعات ژنتیکی دریافت کند. دوک میتوزی نیز کشیده و مستحکم میشود تا کروماتیدها را به طور مساوی از هم جدا کند.
آنافاز
در این مرحله، کروماتیدهای خواهری از هم جدا میشوند و به سمت قطبهای مخالف سلول کشیده میشوند. این حرکت توسط کوتاه شدن میکروتوبولهای دوک میتوزی انجام میشود. جدا شدن کروماتیدها تضمین میکند که هر سلول دختر مجموعهای کامل از کروموزومها دریافت کند. این مرحله نقطه عطفی در تقسیم سلولی است زیرا کروماتیدهای جدا شده به سلولهای دختر اختصاص مییابند.
تلوفاز
مرحله نهایی میتوز که طی آن کروموزومها در هر قطب سلول شروع به دکاندنس و باز شدن به حالت کروماتین میکنند و غشای هسته جدیدی اطراف هر مجموعه کروموزوم تشکیل میشود. همچنین دوک میتوزی از بین میرود و سلول آماده مرحله بعدی، یعنی سیتوکینز (تقسیم سیتوپلاسم) میشود. این مرحله پایان تقسیم هسته است و زمینه را برای تقسیم سلولی کامل فراهم میکند.
با اتمام این مراحل، تقسیم هسته به پایان میرسد و سلول به دو سلول دختر تقسیم میشود. این فرآیند به دقت و هماهنگی بالایی نیاز دارد تا سلامت و ثبات ژنتیکی حفظ شود.
ساختارها و مولکولهای کلیدی در میتوز
میتوز یک فرایند بسیار دقیق و منظم است که نیازمند تعامل پیچیدهای میان چندین ساختار و مولکول کلیدی است تا تقسیم سلولی به درستی انجام شود. شناخت این اجزا به درک بهتر روند میتوز و چگونگی تنظیم آن در سلول کمک شایانی میکند. در این بخش، به بررسی مهمترین ساختارها و مولکولهای درگیر در میتوز میپردازیم.
کروماتیدها و کروموزومها
کروموزومها، حاملان اصلی اطلاعات ژنتیکی در سلول هستند که در طول میتوز به صورت کروماتیدهای خواهری دو برابر میشوند. هر کروموزوم از دو کروماتید خواهری تشکیل شده که در ناحیهای به نام سانترومر به هم متصلاند. کروماتیدها نقش کلیدی در انتقال دقیق و برابر DNA به سلولهای دختر دارند. این کروماتیدها باید به صورت متقارن و بدون خطا جدا شوند تا از بروز ناهنجاریهای ژنتیکی جلوگیری شود.
میژهها (کینتوکور)
میژه یا کینتوکور ناحیهای پروتئینی است که روی سانترومر کروماتید قرار دارد و نقطه اتصال میکروتوبولهای دوک میتوزی به کروماتیدها محسوب میشود. میژه به عنوان یک واسطه عمل میکند که ارتباط میان کروموزومها و سیستم میکروتوبولی سلول را فراهم میسازد. این اتصال به میکروتوبولها اجازه میدهد کروماتیدها را به قطبهای مخالف سلول بکشد.
دوک میتوزی و میکروتوبولها
دوک میتوزی ساختاری متشکل از میکروتوبولها است که از Centrosome (مرکز سازماندهی میکروتوبولها) منشأ میگیرد. میکروتوبولها فیبرهای لولهای شکلی هستند که وظیفه جابجایی کروماتیدها را برعهده دارند.
- میکروتوبولهای دوک : مستقیماً به میژه متصل شده و کروماتیدها را به سمت قطبهای مخالف سلول میکشند.
- میکروتوبولهای قطبی : بین قطبهای دوک کشیده شده و به تثبیت دوک کمک میکنند.
- میکروتوبولهای شعاعی : نقش در حفظ موقعیت کروموزومها در متافاز دارند.
مرکز سازماندهی میکروتوبولها (Centrosome)
مرکز یا مرکزک یکی از ساختارهای کلیدی در تنظیم میتوز است که به صورت جفتی در سلول وجود دارد و مسئول تولید و سازماندهی میکروتوبولهاست. در شروع میتوز، مرکزکها به قطبهای مخالف سلول مهاجرت میکنند و دوک میتوزی را شکل میدهند.
پروتئینهای تنظیمکننده و کینازها
فرآیند میتوز توسط شبکهای از پروتئینهای تنظیمی کنترل میشود که مهمترین آنها کمپلکسهای سیکلین-کیناز (Cyclin-Cdk) هستند. این کمپلکسها در کنترل عبور سلول از مراحل مختلف چرخه سلولی و شروع میتوز نقش کلیدی دارند. علاوه بر آن، کینازهایی مانند Aurora و Polo-like kinase (PLK) نیز تنظیم مراحل مختلف میتوز را برعهده دارند، از جمله تنظیم دوک میتوزی، اتصال کروموزومها، و جداسازی کروماتیدها.
پروتئینهای متصلکننده کروماتید (Cohesin)
این پروتئینها کروماتیدهای خواهری را در طول میتوز به هم متصل نگه میدارند تا زمان مناسب برای جدا شدنشان فرا برسد. در آنافاز، این اتصال توسط آنزیمهای خاصی مانند Separase قطع میشود تا کروماتیدها بتوانند جدا شوند.
سایر مولکولهای مهم
- توبولین : واحد سازنده میکروتوبولها که به صورت داینامیک به هم متصل و جدا میشود و به حرکت دوک کمک میکند.
- موتور پروتئینها (مانند کینسین و داینئین( : این پروتئینها به حرکت کروماتیدها در طول میکروتوبولها کمک میکنند.
- پروتئینهای ساختاری هسته : در تلوفاز به بازسازی غشای هسته و سازماندهی مجدد کروماتین کمک میکنند.
درک این ساختارها و مولکولها برای فهم روند دقیق میتوز و نحوه تنظیم آن اهمیت فراوانی دارد، به ویژه در زمینههایی مانند رشد سلولی، ترمیم بافت، و تحقیقات سرطانشناسی که اختلال در میتوز میتواند منجر به بیماریهای جدی شود.
نقش شکل و اندازه سلول در میتوز
شکل و اندازه سلول از عوامل کلیدی در فرآیند میتوز هستند که نه تنها بر نحوه تقسیم سلول بلکه بر کیفیت و دقت انتقال مواد ژنتیکی به سلولهای دختر تأثیر میگذارند. در طول سالهای اخیر، تحقیقات گستردهای نشان دادهاند که تنظیم فیزیکی سلول نقش مهمی در هماهنگی مراحل میتوز و حتی جهتگیری تقسیم سلولی ایفا میکند.
اهمیت شکل سلول در میتوز
شکل سلول میتواند به طور مستقیم بر چگونگی آرایش دوک میتوزی و تراز شدن کروموزومها تأثیر بگذارد. سلولهایی که شکلهای نامتقارن یا غیرطبیعی دارند، ممکن است در سازماندهی میکروتوبولها و اتصال به کروماتیدها دچار مشکل شوند، که این میتواند منجر به تقسیم نامتوازن و در نهایت بروز اختلالات ژنتیکی شود.
مطالعات نشان دادهاند که در حیوانات، شکل سلول پیش از شروع میتوز نقش مهمی در جهتگیری دوک میتوزی دارد و به همین دلیل تقسیم سلولی میتواند به صورت متقارن یا نامتقارن تنظیم شود، که در فرآیندهای تمایز سلولی و توسعه بافتها بسیار حیاتی است.
نقش اندازه سلول در تنظیم میتوز
اندازه سلول، خصوصاً نسبت سطح به حجم آن، یکی از شاخصهای مهمی است که سلول برای تصمیمگیری ورود به میتوز از آن استفاده میکند. به طور کلی، سلولها برای تقسیم نیاز دارند تا پس از رشد کافی، به اندازهای برسند که بتوانند مواد لازم را برای دو سلول جدید تامین کنند.
چرخه سلولی به گونهای طراحی شده است که اگر سلول به اندازه مطلوب نرسیده باشد، ورود به میتوز به تعویق میافتد. این کنترل باعث میشود تا سلولها از تقسیم زودهنگام که ممکن است منجر به سلولهای ناقص شود، جلوگیری کنند.
مکانیزمهای حسگر شکل و اندازه
سلولها از طریق سگنالهای مکانیکی و شیمیایی قادر به تشخیص تغییرات شکل و اندازه خود هستند. به طور مثال، پروتئینهای مرتبط با اسکلت سلولی مانند اکتین و میوزین در تنظیم شکل و نیروهای داخلی سلول نقش دارند و سیگنالهای آنها به هسته منتقل میشود تا تنظیمات چرخه سلولی را هدایت کند.
تأثیر تغییر شکل و اندازه سلول در بیماریها
هرگونه اختلال در تنظیم شکل یا اندازه سلول میتواند پیامدهای شدیدی داشته باشد. برای مثال، در بسیاری از سرطانها، سلولها به طور غیرطبیعی بزرگ شده یا شکلشان تغییر میکند که باعث تقسیم نادرست و ایجاد سلولهای سرطانی با ناهنجاریهای ژنتیکی میشود.
خلاصه اینکه، شکل و اندازه سلول نه تنها ویژگیهای فیزیکی ساده نیستند، بلکه عاملهای حیاتی و فعال در تنظیم فرآیند میتوز محسوب میشوند. این ویژگیها کمک میکنند تا سلولها به صورت دقیق و منظم تقسیم شوند و سلامت بافتها حفظ شود. درک بهتر این نقشها میتواند مسیر درمان بیماریهایی مانند سرطان را بهبود بخشد.
میوز: تعریف و اهمیت
میوز فرآیندی حیاتی و تخصصی از تقسیم سلولی است که در سلولهای جنسی (گامتها) رخ میدهد و نقش کلیدی در حفظ ثبات ژنتیکی گونهها ایفا میکند. برخلاف میتوز که منجر به تولید دو سلول دختر با اطلاعات ژنتیکی یکسان میشود، میوز با کاهش تعداد کروموزومها به نصف، سلولهای جنسی با تنوع ژنتیکی بالا تولید میکند.
تعریف میوز
میوز نوعی تقسیم سلولی است که طی آن یک سلول دو نسخه از هر کروموزوم (دیپلوئید) را به چهار سلول با نصف تعداد کروموزومها (هاپلوئید) تبدیل میکند. این کاهش تعداد کروموزومها برای تولید گامتهای نر و ماده ضروری است تا پس از لقاح، سلول تخم با تعداد کروموزوم کامل تشکیل شود.
میوز شامل دو مرحله اصلی است:
- میوز اول (تقسیم کاهشدهنده) که در آن کروموزومها جفت شده و تبادل مواد ژنتیکی (رد و بدل شدن قطعات کروماتید یا کراسینگ اوور) انجام میشود.
- میوز دوم (تقسیم مساوی( که شبیه میتوز است و در آن کروماتیدهای خواهر جدا شده و به سلولهای دختر منتقل میشوند.
اهمیت میوز در حفظ تنوع ژنتیکی
یکی از برجستهترین ویژگیهای میوز، افزایش تنوع ژنتیکی در نسلهای بعدی است که ناشی از فرآیند کراسینگ اوور و ترکیب تصادفی کروموزومها در سلولهای جنسی است. این تنوع ژنتیکی موجب سازگاری بهتر گونهها با محیطهای متغیر و افزایش احتمال بقا در شرایط مختلف میشود.
نقش میوز در تولید مثل و بقای نسل
بدون میوز، تعداد کروموزومها در هر نسل به طور مداوم افزایش مییافت که منجر به ناپایداری ژنتیکی و اختلال در رشد و تکامل میشد. میوز تضمین میکند که تعداد کروموزومها در هر نسل ثابت بماند و سلولهای جنسی بتوانند وظیفه خود را به درستی انجام دهند.
کاربردهای بالینی و اهمیت پزشکی میوز
اختلالات در فرآیند میوز میتوانند منجر به مشکلات جدی مانند سندرم داون، سندرم ترنر، و ناباروریهای مختلف شوند. درک عمیق مکانیزمهای میوز به توسعه روشهای تشخیص، درمان ناباروری، و پیشگیری از اختلالات ژنتیکی کمک میکند.
میوز نه تنها یک فرآیند تقسیم سلولی پیچیده و دقیق است، بلکه اساس تنوع زیستی و سلامت نسلهای آینده به شمار میآید. شناخت کامل این فرآیند از منظر زیستشناسی سلولی و پزشکی، زمینهساز پیشرفتهای درمانی و بیوتکنولوژیکی فراوانی خواهد بود.
مراحل میوز و تفاوتهای کلیدی آن با میتوز
مراحل میوز
میوز، برخلاف میتوز که شامل یک مرحله تقسیم است، شامل دو مرحله تقسیم متوالی به نامهای میوز اول و میوز دوم میباشد. این دو مرحله در مجموع منجر به تولید چهار سلول دختر با نصف تعداد کروموزومهای سلول مادری میشوند. مراحل اصلی میوز به شرح زیر هستند:
- میوز اول (تقسیم کاهشدهنده( :
- پروفاز اول : کروموزومهای همتا (هر کدام شامل دو کروماتید خواهر) به صورت جفتهای همولوگ کنار هم قرار میگیرند. در این مرحله اتفاق مهمی به نام کراسینگ اوور رخ میدهد که طی آن بخشهایی از کروماتیدهای همتا تبادل میشوند و باعث تنوع ژنتیکی میشوند.
- متافاز اول : جفتهای کروموزومهای همولوگ در صفحه متافازی مرتب میشوند.
- آنافاز اول : کروموزومهای همولوگ جدا شده و به سمت قطبهای مخالف سلول کشیده میشوند. این مرحله باعث کاهش تعداد کروموزومها به نصف میشود.
- تلوفاز اول : کروموزومها به قطبها میرسند و سلول به دو سلول دختر تقسیم میشود. هر سلول دارای نصف تعداد کروموزومهای اولیه است اما هر کروموزوم هنوز شامل دو کروماتید خواهر است.
- میوز دوم (تقسیم مساوی( :
- مشابه میتوز است و در آن کروماتیدهای خواهر از هم جدا شده و به سلولهای دختر جدید منتقل میشوند.
- این مرحله شامل پروفاز دوم، متافاز دوم، آنافاز دوم و تلوفاز دوم است که طی آن چهار سلول هاپلوئید تشکیل میشود.
تفاوتهای کلیدی بین میوز و میتوز
- تعداد تقسیمات:
- میتوز شامل یک تقسیم است که دو سلول دختر تولید میکند.
- میوز شامل دو تقسیم متوالی است که چهار سلول دختر هاپلوئید تولید میکند.
- نوع سلول تولیدی:
- میتوز سلولهای سوماتیک (بدنی) را تولید میکند و سلولهای دختر ژنتیکی مشابه سلول مادر هستند.
- میوز سلولهای جنسی (گامت) را تولید میکند که دارای تنوع ژنتیکی و نصف تعداد کروموزومها هستند.
- کراسینگ اوور:
- در میوز رخ میدهد و منجر به تبادل مواد ژنتیکی بین کروموزومهای همولوگ میشود.
- در میتوز چنین فرآیندی وجود ندارد.
- نتیجه ژنتیکی:
- میتوز نتیجهای از سلولهای دختر با ژنوم مشابه سلول مادری دارد.
- میوز تنوع ژنتیکی و کاهش تعداد کروموزومها را تضمین میکند.
- نقش زیستی:
- میتوز برای رشد، ترمیم و جایگزینی سلولهای آسیبدیده ضروری است.
- میوز برای تولید گامتها و حفظ ثبات کروموزومی در نسلهای بعدی حیاتی است.
درک دقیق مراحل و تفاوتهای میان میوز و میتوز، پایهای برای فهم فرآیندهای حیاتی مانند تولید مثل، رشد و پیشگیری از بیماریهای ژنتیکی است. این دانش به متخصصان زیستشناسی و پزشکی کمک میکند تا به طور مؤثری به مسائل مرتبط با تقسیم سلولی و اختلالات آن بپردازند.
نقش میوز در تنوع ژنتیکی و تولید مثل جنسی
میوز به عنوان یک فرآیند حیاتی در تولید مثل جنسی نقشی بیبدیل دارد، چرا که علاوه بر کاهش تعداد کروموزومها به نصف، باعث ایجاد تنوع ژنتیکی در نسلهای بعدی میشود. این تنوع پایه و اساس سازگاری و تکامل گونههاست.
کاهش تعداد کروموزومها و حفظ ثبات ژنتیکی
یکی از مهمترین وظایف میوز، کاهش تعداد کروموزومها از دو نسخه (دیپلوئید) به یک نسخه (هاپلوئید) در سلولهای جنسی است. این امر تضمین میکند که در هنگام لقاح، با ادغام دو گامت (نر و ماده)، تعداد کروموزومها به حالت اولیه خود بازگردد و از افزایش غیرطبیعی تعداد کروموزومها جلوگیری شود.
ایجاد تنوع ژنتیکی از طریق کراسینگ اوور
در طول پروفاز اول میوز، فرآیندی به نام کراسینگ اوور یا تبادل قطعات کروماتیدهای همولوگ رخ میدهد. این فرآیند موجب میشود که بخشهایی از ماده ژنتیکی بین کروماتیدهای همتا مبادله شود و ترکیبهای جدیدی از ژنها شکل بگیرد. این تنوع ژنتیکی باعث افزایش انعطافپذیری و قابلیت سازگاری نسلهای بعدی با تغییرات محیطی میشود.
جدایی تصادفی کروموزومهای همولوگ
در آنافاز اول میوز، کروموزومهای همولوگ به طور تصادفی به سمت قطبهای مخالف سلول کشیده میشوند. این جدایی تصادفی یا جدایی مستقل کروموزومها، یکی دیگر از منابع مهم تنوع ژنتیکی است که باعث میشود ترکیبهای مختلفی از کروموزومها در سلولهای دختر ایجاد شود.
اهمیت میوز در تولید مثل جنسی
بدون وجود میوز، گامتها دارای همان تعداد کروموزوم سلولهای بدن بودند و لقاح منجر به افزایش دو برابری تعداد کروموزومها در هر نسل میشد، که به طور ژنتیکی پایدار نبود. میوز این مشکل را با کاهش تعداد کروموزومها در گامتها حل میکند و از ایجاد سلولهای ناسالم و بیماریهای ژنتیکی جلوگیری مینماید.
در مجموع، میوز نه تنها مسئول کاهش تعداد کروموزومها بلکه محرک اصلی ایجاد تنوع ژنتیکی در موجودات زنده است. این ویژگی، اساس بقای گونهها در برابر تغییرات محیطی و پایهای برای فرایندهای تکاملی محسوب میشود. بدون میوز، تولید مثل جنسی و تکامل زیستی به شکل امروزی امکانپذیر نبود.
مقایسه دقیق میتوز و میوز: کاربردها و تفاوتها
میتوز و میوز دو فرآیند بنیادی تقسیم سلولی هستند که هر کدام نقشها و ویژگیهای متمایزی دارند. شناخت تفاوتها و کاربردهای هر یک برای درک بهتر بیولوژی سلولی و فرآیندهای تولید مثل حیاتی است.
کاربردهای میتوز
میتوز عمدتاً در رشد، ترمیم بافتها، و جایگزینی سلولهای آسیبدیده یا فرسوده نقش دارد. این فرآیند باعث میشود سلولهای جدیدی تولید شوند که از نظر ژنتیکی کاملاً مشابه سلول مادر باشند، به طوری که ثبات ژنتیکی در بافت حفظ شود. در موجودات تکسلولی، میتوز نقش تولید مثل غیرجنسی را نیز بر عهده دارد.
کاربردهای میوز
میوز تنها در تولید گامتها (سلولهای جنسی) کاربرد دارد و مسئول کاهش تعداد کروموزومها به نصف (هاپلوئید شدن) است. این فرآیند پایه و اساس تولید مثل جنسی است و موجب ایجاد تنوع ژنتیکی در نسلهای بعدی میشود که به بقای گونهها و تطابق با محیط کمک میکند.
تفاوتهای اصلی در ساختار و نتایج تقسیم سلولی
- تعداد دورهای تقسیم:
میتوز شامل یک دور تقسیم سلولی است که منجر به تولید دو سلول دختر مشابه میشود.
میوز شامل دو دور تقسیم پیاپی (میوز I و میوز II) است که چهار سلول دختر هاپلوئید تولید میکند. - تعداد سلولهای حاصل:
میتوز دو سلول دختر میسازد، هر کدام دیپلوئید و ژنتیکی مشابه سلول مادر.
میوز چهار سلول دختر تولید میکند که هر کدام هاپلوئید و ژنتیکی متفاوت هستند. - کاهش تعداد کروموزوم:
در میتوز، تعداد کروموزوم ثابت میماند (دیپلوئید).
در میوز، تعداد کروموزوم نصف میشود (از دیپلوئید به هاپلوئید). - کراسینگ اوور (تبادل ژنتیکی(:
در میتوز رخ نمیدهد.
در میوز، در پروفاز I کراسینگ اوور رخ میدهد که باعث تنوع ژنتیکی میشود. - نقش در تنوع ژنتیکی:
میتوز تنوع ژنتیکی ایجاد نمیکند.
میوز نقش اساسی در ایجاد تنوع ژنتیکی دارد.
مقایسه ساختاری مراحل کلیدی
- در میتوز، کروماتیدهای خواهری در متافاز به صورت خطی در صفحه استوا قرار میگیرند.
- در میوز I، کروموزومهای همولوگ به صورت جفتهای کنار هم (بیوِلِنت) در صفحه استوا قرار میگیرند و سپس به قطبهای مخالف کشیده میشوند.
اهمیت زیستی و پیامدهای عدم انجام درست فرآیندها
- اشکال در میتوز ممکن است منجر به سرطان یا بیماریهای مرتبط با تقسیم سلولی شود.
- اختلال در میوز میتواند منجر به ناباروری، اختلالات کروموزومی مانند سندرم داون و مشکلات ژنتیکی شود.
میتوز و میوز هر دو فرآیندهای حیاتی در چرخه حیات سلولی هستند، اما هر کدام کاربردها و ویژگیهای خاص خود را دارند. میتوز تضمینکنندهی رشد و ترمیم بافتهاست، در حالی که میوز مسئول تولید مثل جنسی و ایجاد تنوع ژنتیکی است. شناخت دقیق تفاوتهای این دو فرآیند، پایهای برای درک بهتر فیزیولوژی سلولی و زیستشناسی تولید مثل است.
چرخه سلولی و ارتباط آن با سرطان: چگونگی اختلال در تقسیم سلولی منجر به سرطان میشود
چرخه سلولی مجموعهای منظم از مراحل است که یک سلول برای رشد، تقسیم و تکثیر طی میکند. این فرآیند دقیقاً تحت کنترل سیستمهای مولکولی پیچیده قرار دارد تا تقسیم سلولی فقط در زمان و مکان مناسب انجام شود. هرگونه اختلال در تنظیم صحیح چرخه سلولی میتواند منجر به رشد غیرقابل کنترل سلولها و در نهایت سرطان شود.
نقش کنترلکنندههای چرخه سلولی در حفظ تعادل
سلولها در طول چرخه سلولی نقاط کنترل (چکپوینتها) مختلفی دارند که عملکرد صحیح فرایندهای تقسیم را تضمین میکنند. این نقاط شامل:
- چکپوینت : G1/S بررسی سلامت DNA و آمادگی سلول برای ورود به مرحله سنتز (S).
- چکپوینت : G2/M اطمینان از اینکه همه DNA به طور کامل و بدون خطا تکثیر شده باشد.
- چکپوینت متافاز : (M) بررسی اتصال کروموزومها به دوک تقسیم و توزیع صحیح کروموزومها.
اختلال در کنترل چرخه سلولی و نقش آن در سرطان
سرطان در واقع یک بیماری تقسیم سلولی بیرویه و غیرقابل کنترل است. این وضعیت ناشی از جهشهای ژنتیکی یا تغییرات اپیژنتیکی است که در پروتئینها و مولکولهای تنظیمکننده چرخه سلولی ایجاد میشود. به طور مثال:
- تغییر یا از دست رفتن عملکرد ژنهای سرکوبگر تومور مانند p53 که نقش اصلی در توقف چرخه سلولی در صورت وجود آسیب DNA دارد.
- فعالسازی بیش از حد آنکوژنها مانند ژنهایی که تولید پروتئینهای محرک چرخه سلولی (مثلاً سیکلینها و CDKها) را افزایش میدهند.
- اختلال در سیستمهای آپوپتوز که مسئول مرگ برنامهریزی شده سلولهای آسیبدیده است، باعث میشود سلولهای معیوب به جای حذف شدن به تقسیم ادامه دهند.
نتایج اختلالات چرخه سلولی
- تکثیر بیش از حد و تجمع سلولهای غیرطبیعی که منجر به تشکیل تومورهای خوشخیم یا بدخیم میشود.
- عدم کنترل رشد و تقسیم سلولی موجب گسترش سرطان به بافتهای مجاور و در نهایت متاستاز (پخش سرطان به سایر نقاط بدن) میگردد.
نقش داروهای ضدسرطان در هدفگیری چرخه سلولی
بسیاری از درمانهای ضدسرطان به طور مستقیم یا غیرمستقیم چرخه سلولی را هدف قرار میدهند. این داروها با توقف مراحل خاصی از چرخه سلولی، باعث توقف رشد سلولهای سرطانی میشوند. به عنوان مثال:
- داروهای مهارکننده CDK که فعالیت کینازهای وابسته به سیکلین را کاهش میدهند و سلول را در مراحل خاصی از چرخه متوقف میکنند.
- داروهای آسیبرسان به DNA که باعث توقف چرخه سلولی در چکپوینتهای مختلف و القای آپوپتوز میشوند.
چرخه سلولی سالم و تنظیم شده برای حفظ سلامت بافتها و ارگانها حیاتی است. اختلال در این فرآیند به ویژه در نقاط کنترل چرخه، زمینهساز بروز سرطان است. شناخت دقیق مکانیزمهای تنظیم چرخه سلولی و چگونگی بروز اختلالها، کلید توسعه درمانهای هدفمند و مؤثر در مقابله با سرطان است.
تقسیم سلولی و اهمیت آن در سیستم عصبی مرکزی و دیگر بافتها
تقسیم سلولی یکی از فرآیندهای اساسی در حفظ سلامت، رشد و ترمیم بافتهای بدن است. هر بافت با توجه به نقش و ماهیت خود، الگوهای خاصی از تقسیم سلولی را دارد که برای عملکرد بهینه آن حیاتی است.
نقش تقسیم سلولی در سیستم عصبی مرکزی
در سیستم عصبی مرکزی (CNS)، تقسیم سلولی نقشی متفاوت و بسیار حساس نسبت به دیگر بافتها ایفا میکند. برخلاف بسیاری از سلولهای بدن که به طور مداوم تقسیم میشوند، نورونهای بالغ در CNS عموماً توانایی تقسیم مجدد را از دست دادهاند و بیشتر تکثیر سلولی در این سیستم مربوط به سلولهای گلیا است.
- سلولهای گلیا (مانند آستروسیتها، الیگودندروسیتها و میکروگلیا) در طول زندگی میتوانند تقسیم شده و نقشهای حمایتی، تغذیهای و حفاظتی برای نورونها ایفا کنند.
- سلولهای بنیادی عصبی (Neural stem cells) در نواحی خاصی از مغز مانند هیپوکامپ و منطقه زیربطنی باقی میمانند و توانایی تقسیم و تمایز به نورونها و سلولهای گلیا را دارند. این فرایند در یادگیری، حافظه و ترمیم آسیبهای عصبی نقش مهمی دارد.
اهمیت تقسیم سلولی در دیگر بافتها
در بافتهای دیگر بدن، تقسیم سلولی معمولاً نقش حیاتیتری در ترمیم، رشد و حفظ عملکرد ایفا میکند:
- بافتهای اپیتلیال مانند پوست و لایه داخلی روده به طور مداوم سلولهای خود را بازسازی میکنند تا از آسیبهای فیزیکی و عفونتها جلوگیری شود.
- بافتهای عضلانی و استخوانی نیز با تقسیم سلولی و تمایز سلولهای بنیادی خود، توانایی ترمیم پس از آسیب را دارند.
- بافتهای خونی مانند مغز استخوان، با تولید سلولهای جدید خونی، سلامت سیستم ایمنی و انتقال اکسیژن را تضمین میکنند.
چالشهای تقسیم سلولی در سیستم عصبی مرکزی
از آنجا که تقسیم سلولی نورونها محدود است، آسیب به این سلولها اغلب جبرانناپذیر است و باعث بروز بیماریهای عصبی مانند پارکینسون، آلزایمر و سکته مغزی میشود. این موضوع اهمیت مطالعات مربوط به تحریک تقسیم سلولی و تکثیر سلولهای بنیادی عصبی را برای درمانهای بازسازی عصبی دوچندان کرده است.
تقسیم سلولی پایه و اساس حفظ سلامت و عملکرد بافتهای مختلف است، اما میزان و نوع آن بسته به نوع بافت متفاوت است. در سیستم عصبی مرکزی، تقسیم سلولی محدود به سلولهای گلیا و سلولهای بنیادی عصبی است که نقش کلیدی در یادگیری و ترمیم دارند، در حالی که در بسیاری از بافتهای دیگر، تقسیم سلولی مداوم و پویا برای حفظ عملکرد طبیعی حیاتی است. شناخت عمیقتر این فرایندها میتواند به توسعه درمانهای نوین برای بیماریها و آسیبهای بافتی کمک شایانی نماید.
تقسیم سلولی غیرمعمول: تقسیم نامتقارن و پیامدهای آن در توسعه و بیماریها
تقسیم سلولی نامتقارن یکی از انواع خاص و بسیار مهم تقسیم سلولی است که نقش کلیدی در توسعه جنین، حفظ سلولهای بنیادی و عملکرد بافتها دارد. برخلاف تقسیم سلولی متقارن که منجر به تولید دو سلول دختر مشابه میشود، در تقسیم نامتقارن، سلول مادر به دو سلول دختر با ویژگیها و سرنوشتهای متفاوت تقسیم میشود.
ویژگیها و اهمیت تقسیم نامتقارن
- در این نوع تقسیم، دو سلول حاصل از تقسیم، یک سلول معمولاً همچنان خواص سلول بنیادی را حفظ میکند، در حالی که سلول دیگر وارد مسیر تمایزی شده و به سلول تخصصی تبدیل میشود.
- این فرآیند برای حفظ تعادل بین تجدید سلولهای بنیادی و تولید سلولهای تخصصی ضروری است.
- تقسیم نامتقارن در بسیاری از بافتها، بهویژه در سیستم عصبی، پوست، و دستگاه ایمنی اهمیت حیاتی دارد.
مکانیزمهای تقسیم نامتقارن
- قطببندی سلولی: پیش از تقسیم، سلول مادر قطببندی شده و مولکولها، اندامکها و فاکتورهای رشد به طور نامتقارن در بخشهای مختلف سلول توزیع میشوند.
- تخصیص نامتقارن عوامل تنظیمی : این مولکولها به سلولهای دختر مختلف منتقل میشوند و تعیینکننده سرنوشت آنها میباشند.
- ساختارهای اسکلت سلولی و میکروتوبولها نقش مهمی در جهتدهی تقسیم و توزیع محتویات سلولی ایفا میکنند.
نقش تقسیم نامتقارن در توسعه و حفظ بافتها
- در توسعه جنینی، تقسیم نامتقارن به تولید سلولهای مختلف با عملکردهای گوناگون کمک میکند و باعث تنوع سلولی میشود.
- در بافتهای بالغ، این نوع تقسیم برای نگهداری جمعیت سلولهای بنیادی و ترمیم بافت حیاتی است. برای مثال، در مغز، سلولهای بنیادی عصبی از طریق تقسیم نامتقارن قادر به حفظ خود و تولید نورونهای جدید هستند.
پیامدهای اختلال در تقسیم نامتقارن
- اختلال در این فرآیند میتواند منجر به بیماریهای جدی شود، از جمله سرطانها، چرا که عدم تعادل بین تجدید سلولهای بنیادی و تمایز سلولی ممکن است باعث تکثیر بیرویه و ایجاد تومورها شود.
- در بیماریهای عصبی، اختلال در تقسیم نامتقارن سلولهای بنیادی عصبی میتواند به کاهش تولید نورونها و مشکلات عملکردی منجر شود.
- همچنین، نواقص در این فرآیند ممکن است با اختلالات ژنتیکی و بیماریهای متابولیک مرتبط باشد.
تقسیم سلولی نامتقارن، به عنوان یک مکانیزم حیاتی در حفظ تعادل بین تجدید سلولهای بنیادی و تولید سلولهای تخصصی، نقش اساسی در توسعه، ترمیم بافت و حفظ سلامت بدن ایفا میکند. فهم بهتر این فرآیند و مکانیزمهای تنظیم آن میتواند راهگشای درمانهای نوین برای بیماریهای متنوع از جمله سرطان و اختلالات عصبی باشد. اختلال در تقسیم نامتقارن نه تنها توسعه طبیعی را مختل میکند بلکه میتواند زمینهساز بیماریهای مزمن و کشنده شود، که اهمیت تحقیقات در این حوزه را دوچندان میسازد.
نقش اجزای سلولی مانند دستگاه گلژی، غشاها و اسکلت سلولی در فرآیند تقسیم
فرآیند تقسیم سلولی بهطور پیچیدهای وابسته به هماهنگی میان اجزای مختلف سلولی است که هر یک نقش ویژهای در تضمین دقت و موفقیت تقسیم ایفا میکنند. در این میان، دستگاه گلژی، غشاهای سلولی و اسکلت سلولی از اهمیت خاصی برخوردارند.
دستگاه گلژی و نقش آن در تقسیم سلولی
- دستگاه گلژی به عنوان مرکزی برای پردازش و بستهبندی پروتئینها و لیپیدها شناخته میشود و نقش مهمی در آمادهسازی اجزای مورد نیاز برای ساخت غشاهای جدید و اندامکهای سلولی دارد.
- در طول تقسیم سلولی، دستگاه گلژی به تولید وزیکولهایی میپردازد که در تشکیل غشاهای جدید برای سلولهای دختر نقش دارند، به خصوص در مرحلهی تلوفاز و سایتوکینز که جداسازی سلولها به پایان میرسد.
- علاوه بر این، دستگاه گلژی در تنظیم انتقال پروتئینها و آنزیمهای لازم برای فرآیندهای مختلف تقسیم سلولی موثر است.
غشاهای سلولی و اهمیت آنها در تقسیم
- غشای سلولی نقش کلیدی در جدا کردن سلولهای دختر دارد، بهویژه در مرحلهی نهایی تقسیم که به آن سایتوکینز گفته میشود.
- بازسازی غشاهای سلولی جدید و تشکیل حلقهی سایتوکینزی (که از فیلامانهای اکتین تشکیل شده) برای انجام جدا شدن فیزیکی دو سلول دختر ضروری است.
- همچنین، غشاها با دخالت در سیگنالدهیهای سلولی و تغییرات دینامیکی شکل سلول، امکان تقسیم دقیق و هماهنگ را فراهم میکنند.
اسکلت سلولی: ستون فقرات ساختاری و عملکردی تقسیم سلولی
- اسکلت سلولی متشکل از سه جزء اصلی است: میكروتوبولها، فیلامانهای اکتین و فیلامانهای واسطهای.
- میكروتوبولها در تشکیل دوک میتوزی (spindle apparatus) نقش حیاتی دارند که کروماتیدها را به طور مساوی بین سلولهای دختر تقسیم میکند.
- فیلامانهای اکتین در تشکیل حلقهی تقسیم و کمک به سایتوکینز نقش اساسی دارند.
- فیلامانهای واسطهای به حفظ یکپارچگی ساختاری سلول و حمایت از شکل آن کمک میکنند، بهخصوص در مراحل نهایی تقسیم.
- تغییرات دینامیکی اسکلت سلولی باعث میشود سلول بتواند شکل و حجم خود را برای تقسیم تنظیم کند و اجزای داخل سلول را به درستی جابهجا نماید.
همکاری اجزای سلولی در تقسیم
- دستگاه گلژی، غشاهای سلولی و اسکلت سلولی به صورت هماهنگ عمل میکنند تا تقسیم سلولی با دقت و نظم انجام شود.
- برای مثال، تغییر شکل غشاها و انتقال وزیکولهای ساخته شده توسط دستگاه گلژی، در کنار بازآرایی میكروتوبولها و فیلامانهای اکتین، امکان ایجاد سلولهای دختر با ساختار سالم را فراهم میکند.
- این همکاری پیچیده و هماهنگ تضمین میکند که نه تنها محتویات سلول به درستی تقسیم شود، بلکه ساختار و عملکرد سلولهای حاصل نیز حفظ گردد.
اجزای سلولی مانند دستگاه گلژی، غشاها و اسکلت سلولی در موفقیت فرآیند تقسیم سلولی نقشهای حیاتی و مکمل دارند. بدون هماهنگی دقیق بین این ساختارها، تقسیم سلولی نمیتواند با دقت لازم انجام شود و این امر میتواند منجر به مشکلاتی همچون تقسیم نامتقارن غیرطبیعی، نقص در تعداد کروموزومها یا حتی مرگ سلولی شود. بنابراین، مطالعه و درک بهتر عملکرد این اجزا در تقسیم سلولی، کلید توسعه روشهای درمانی برای بیماریهایی مانند سرطان و اختلالات رشد سلولی است.
مکانیسمهای کنترلی و توقف چرخه سلولی: جلوگیری از تقسیم غیرطبیعی
چرخه سلولی به وسیله شبکهای از مکانیسمهای کنترلی دقیق تنظیم میشود تا از تقسیم غیرطبیعی و آسیبهای ژنتیکی جلوگیری کند. این مکانیسمها در نقاط بازبینی (checkpoints) مختلفی قرار دارند که سلامت و صحت فرآیندهای درون سلولی را تضمین میکنند.
نقاط بازبینی اصلی در چرخه سلولی
- نقطه بازبینی : G1/S این نقطه تعیین میکند که آیا سلول وارد مرحله سنتز DNA شود یا خیر. در این مرحله، سلول برای آسیبهای DNA یا شرایط نامساعد محیطی بررسی میشود. در صورت وجود آسیب، چرخه سلولی متوقف شده و مکانیسمهای تعمیر DNA فعال میشوند.
- نقطه بازبینی : G2/M قبل از ورود به میتوز، سلول بررسی میکند که آیا DNA به طور کامل و بدون نقص تکثیر شده است یا نه. این نقطه از ورود سلول به مرحله میتوز در صورت وجود هرگونه خطا جلوگیری میکند.
- نقطه بازبینی متافاز) Sیتوکنز) : در این مرحله بررسی میشود که آیا کروماتیدهای خواهر به درستی به دوک میتوزی متصل شدهاند یا خیر، تا تقسیم کروموزومها به طور مساوی انجام شود.
نقش پروتئینهای کلیدی در کنترل چرخه سلولی
- پروتئین : p53 به عنوان "نگهبان ژنوم" شناخته میشود و در پاسخ به آسیب DNA فعال میشود. p53 میتواند چرخه سلولی را در نقطه G1 متوقف کند تا سلول فرصت ترمیم پیدا کند یا در صورت آسیب غیرقابل جبران، مسیر آپوپتوز را آغاز کند.
- سیکلینها و کینازهای وابسته به سیکلین : (CDKs) این پروتئینها به صورت چرخهای فعال و غیرفعال میشوند و مراحل مختلف چرخه سلولی را پیش میبرند. کنترل دقیق فعالیت آنها از طریق تنظیم همزمان سیکلینها و مهارکنندههای CDK از تقسیم غیرطبیعی جلوگیری میکند.
- مهارکنندههای : CDK (CKIs) مانند p21 و p27 که در شرایط استرس سلولی یا آسیب DNA فعال میشوند و فعالیت CDKها را مهار کرده، چرخه سلولی را متوقف میکنند.
مکانیسمهای پاسخ به آسیب DNA
- سلول دارای مسیرهای متعددی برای شناسایی و اصلاح آسیبهای DNA است. در صورت تشخیص آسیب، پروتئینهای حسگر مانند ATM و ATR فعال میشوند و پیامهایی را به پروتئینهایی مانند p53 ارسال میکنند تا فرآیندهای ترمیم یا توقف چرخه فعال شوند.
- در صورت عدم موفقیت در ترمیم، سلول مسیر مرگ برنامهریزی شده (آپوپتوز) را طی میکند تا از تکثیر سلولهای آسیبدیده جلوگیری شود.
اهمیت مکانیسمهای کنترلی در جلوگیری از سرطان
- اختلال در مکانیسمهای کنترلی چرخه سلولی منجر به تقسیم بیرویه و تجمع جهشها میشود، که اساس شکلگیری سرطان است.
- به همین دلیل، بسیاری از داروهای ضدسرطان هدفی بر روی این مسیرها دارند تا تقسیم سلولی غیرطبیعی را متوقف کنند یا سلولهای سرطانی را به مسیر مرگ هدایت نمایند.
مکانیسمهای کنترلی چرخه سلولی به عنوان سدهای محافظتی حیاتی، از تقسیم غیرطبیعی سلولها جلوگیری میکنند و سلامت بافتها و ارگانها را حفظ میکنند. درک عمیقتر این مکانیسمها میتواند به توسعه درمانهای موثرتر برای بیماریهای مرتبط با اختلال در تقسیم سلولی کمک کند و نقش کلیدی در پیشگیری و درمان سرطان ایفا نماید.
فناوریها و روشهای نوین برای مطالعه میتوز و میوز
مطالعه دقیق فرآیندهای میتوز و میوز برای درک بهتر تقسیم سلولی و کاربردهای پزشکی آن اهمیت بسیاری دارد. پیشرفتهای تکنولوژیکی در حوزه زیستشناسی سلولی، ابزارهای متنوع و بسیار پیشرفتهای را فراهم کردهاند که امکان بررسی جزئیات این فرآیندها را در سطح مولکولی و سلولی به صورت زنده و دقیق میسر میکنند.
میکروسکوپی فلورسانس و تصویربرداری زنده
- استفاده از میکروسکوپهای فلورسانس با نشانگرهای فلورسانت، مانند GFP (Green Fluorescent Protein)، به محققان این امکان را میدهد که مولکولها و ساختارهای سلولی مانند دوک میتوزی، کروماتیدها و میکروتوبولها را در زمان واقعی مشاهده کنند.
- فناوری تصویربرداری زنده سلولی به کمک میکروسکوپهای کنفوکال و سوپررزولوشن، امکان پیگیری مراحل میتوز و میوز در سلولهای زنده و در شرایط فیزیولوژیک را فراهم میآورد.
فلوئورسانس فعالشده توسط نور (FRET) و تصویرسازی مولکولی
- روش FRET به بررسی تعاملات پروتئینی و تغییرات ساختاری در مولکولهای کلیدی مثل سیکلینها و کینازهای وابسته به سیکلین کمک میکند. این فناوری برای درک بهتر مکانیسمهای تنظیم چرخه سلولی بسیار حیاتی است.
تکنولوژی توالییابی تکسلولی (Single-cell sequencing)
- این روش به مطالعه بیان ژنها در هر سلول به طور مجزا میپردازد و میتواند تغییرات بیان ژنی مرتبط با مراحل مختلف میتوز و میوز را شناسایی کند.
- با این فناوری میتوان heterogeneity (تنوع سلولی) را در جمعیت سلولی بررسی کرد و سلولهایی که به شکل غیرطبیعی تقسیم میشوند را تشخیص داد.
روشهای بیوشیمیایی و مولکولی
- استفاده از ایمونوفلورسانس برای شناسایی پروتئینهای خاص مرتبط با مراحل مختلف میتوز و میوز،
- روشهای وسترن بلات و ایمونوبلاتینگ برای تعیین میزان و زمان بیان پروتئینهای تنظیمکننده چرخه سلولی،
- فناوری کروماتین ایمونوبریپریپیتاسیون (ChIP) برای بررسی تعاملات پروتئینی با DNA در تنظیم ژنهای مربوط به تقسیم سلولی.
مدلهای حیوانی و سلولی مهندسیشده
- استفاده از مدلهای ژنومی دستکاری شده مانند موشهای نوترکیب ژنتیکی (transgenic) و یا سلولهای کشت شده با حذف یا اضافه ژنهای خاص، به درک نقش دقیق مولکولها در فرآیندهای میتوز و میوز کمک میکند.
- این مدلها امکان بررسی اثرات جهشها و اختلالات ژنتیکی بر روی چرخه سلولی را فراهم میآورند.
روشهای تصویربرداری الکترونی
- میکروسکوپ الکترونی عبوری (TEM) و روبشی (SEM) با رزولوشن بسیار بالا، ساختارهای ریزسلولی مانند کروماتیدها و میژهها را با جزئیات بسیار دقیق نشان میدهند.
- این روشها کمک میکنند تا ساختارهای کلیدی و تغییرات فیزیکی در مراحل مختلف تقسیم سلولی بهتر شناخته شوند.
کاربرد هوش مصنوعی و یادگیری ماشین
- با پردازش دادههای تصویربرداری و بیولوژیکی حجیم، الگوریتمهای هوش مصنوعی میتوانند الگوهای پیچیده تقسیم سلولی را شناسایی و تحلیل کنند، و در پیشبینی اختلالات سلولی و بیماریهای مرتبط کمک کنند.
فناوریهای نوین و متنوعی که در مطالعه میتوز و میوز به کار میروند، ابزارهای قدرتمندی برای فهم عمیقتر فرآیندهای تقسیم سلولی فراهم کردهاند. این پیشرفتها نه تنها به درک بهتر زیستشناسی پایه کمک میکنند بلکه زمینه را برای توسعه درمانهای نوین در بیماریهای مرتبط با اختلالات تقسیم سلولی فراهم میآورند.
تقسیم سلولی به عنوان هدف درمان سرطان: رویکردهای دارویی و تحقیقاتی
اختلالات در تقسیم سلولی یکی از عوامل اصلی ایجاد و پیشرفت سرطانها هستند. به همین دلیل، تمرکز بر مکانیزمهای تقسیم سلولی و کنترل آنها به عنوان یک هدف کلیدی در درمان سرطان مورد توجه گسترده قرار گرفته است. داروها و روشهای تحقیقاتی که فرآیندهای مرتبط با تقسیم سلولی را هدف قرار میدهند، میتوانند رشد سلولهای سرطانی را مهار کرده و به کنترل بیماری کمک کنند.
هدفگیری چرخه سلولی در درمان سرطان
- داروهایی که بر مراحل مختلف چرخه سلولی تأثیر میگذارند، مانند مهارکنندههای کینازهای وابسته به سیکلین (CDK inhibitors)، به صورت مؤثری توانستهاند رشد تومورها را متوقف کنند.
- این داروها با ایجاد توقف در نقاط حساس چرخه سلولی، از تقسیم و تکثیر غیرطبیعی سلولهای سرطانی جلوگیری میکنند.
مهار میتوز به عنوان یک استراتژی درمانی
- داروهایی مانند تاکسولها (Paclitaxel) و وینکریستینها که عملکرد میکروتوبولها را مختل میکنند، مانع تشکیل دوک میتوزی میشوند و در نتیجه تقسیم سلولی متوقف میشود.
- این داروها به خصوص در درمان سرطانهای متاستاتیک کاربرد دارند و مانع تکثیر سلولهای سرطانی میشوند.
رویکردهای نوین دارویی و مولکولی
- توسعه مهارکنندههای سیکلی -CDK مانند Palbociclib که به طور خاص مراحل G1/S چرخه سلولی را کنترل میکنند، موجب توقف رشد سرطانهای مختلف، به ویژه سرطان پستان، شدهاند.
- تحقیق روی آنتیبادیهای مونوکلونال و آنتیسرمها که پروتئینهای کلیدی در تقسیم سلولی را هدف قرار میدهند، در حال گسترش است. این رویکردها امکان هدفگیری دقیقتر سلولهای سرطانی را بدون آسیب زیاد به سلولهای سالم فراهم میکنند.
تکنولوژیهای ژندرمانی و RNAi
- استفاده از RNAi (RNA interference) برای خاموشسازی ژنهای مرتبط با تقسیم غیرطبیعی سلولی در سلولهای سرطانی، روشی نوین و مؤثر در تحقیقات سرطان محسوب میشود.
- این روشها میتوانند به طور مستقیم مسیرهای سیگنالی مرتبط با تقسیم سلولی را مهار کنند و در درمان سرطانهای مقاوم به داروها موثر باشند.
ترکیب درمانها برای افزایش اثربخشی
- ترکیب مهارکنندههای چرخه سلولی با شیمیدرمانی یا پرتودرمانی، اثر ضد سرطانی را افزایش میدهد و مقاومت دارویی را کاهش میدهد.
- این رویکردهای ترکیبی باعث میشوند که سلولهای سرطانی در نقاط حساس چرخه سلولی آسیبپذیرتر شوند.
تحقیقات روی مکانیسمهای کنترلی تقسیم سلولی در سرطان
- مطالعه بیشتر درباره نقش پروتئینهای تنظیمکننده چرخه سلولی مانند p53، p21 و راپامايسين (mTOR) در پیشرفت سرطان، مسیرهای جدید درمانی را نمایان ساخته است.
- شناسایی جهشها و اختلالات در ژنهای مرتبط با این مسیرها، امکان طراحی داروهای هدفمند را فراهم میکند.
چالشها و چشمانداز آینده
- یکی از بزرگترین چالشها، هدفگیری دقیق سلولهای سرطانی بدون آسیب به سلولهای طبیعی است که به طور مداوم در چرخه سلولی شرکت میکنند.
- پیشرفت در روشهای تصویربرداری، دارورسانی هدفمند و درمانهای شخصیسازی شده میتواند به کاهش عوارض جانبی و افزایش اثربخشی درمان کمک کند.
تقسیم سلولی به عنوان یک هدف کلیدی در درمان سرطان، زمینه را برای توسعه داروها و روشهای نوین درمانی فراهم کرده است. با پیشرفتهای علمی و تکنولوژیکی، امکان کنترل بهتر فرآیندهای غیرطبیعی تقسیم سلولی و کاهش عوارض جانبی درمانهای فعلی بیش از پیش میسر شده است. این رویکردها به طور قابل توجهی میتوانند در بهبود کیفیت زندگی بیماران سرطانی نقش داشته باشند.
جمعبندی و چشماندازهای آینده در تحقیق و درمان مرتبط با تقسیم سلولی
تقسیم سلولی به عنوان یک فرآیند بنیادی زیستی، نقش حیاتی در حفظ بقاء، رشد و تکامل موجودات زنده ایفا میکند. در این مقاله، مفاهیم کلیدی مربوط به تقسیم سلولی، از جمله چرخه سلولی، مراحل میتوز و میوز، ساختارها و مولکولهای دخیل، و همچنین مکانیزمهای تنظیم آن مورد بررسی قرار گرفت. اهمیت دقیق و هماهنگی این فرآیند در سلامت بافتها و جلوگیری از بروز بیماریهایی مانند سرطان، به خوبی نشان داده شد.
از نظر علمی، پیشرفتهای چشمگیر در فهم مکانیزمهای مولکولی و سلولی تقسیم، مسیر جدیدی برای توسعه داروها و روشهای درمانی ایجاد کردهاند. به ویژه، کشف نقش پروتئینهای تنظیمکننده مانند سیکلینها، کینازهای وابسته به سیکلین، و عوامل کنترلی مانند p53، درک ما را از نحوه کنترل و اختلال در چرخه سلولی عمیقتر کرده است.
چشماندازهای آینده در تحقیق بر روی تقسیم سلولی چندین حوزه کلیدی را شامل میشود:
- تحقیقات مولکولی پیشرفته : استفاده از فناوریهای نوین مانند CRISPR و RNAi برای اصلاح و کنترل دقیق ژنها و مسیرهای سیگنالینگ مرتبط با تقسیم سلولی.
- تصویربرداری زنده و با وضوح بالا : توسعه روشهای تصویربرداری سلولی به صورت زنده و سهبعدی برای مشاهده دقیقتر فرآیندهای تقسیم در زمان واقعی.
- درمانهای هدفمند و شخصیسازی شده : طراحی داروهایی که به صورت اختصاصی مسیرهای اختلالیافته در سلولهای سرطانی یا بیماریهای دیگر را هدف قرار میدهند، با حداقل آسیب به سلولهای سالم.
- مطالعات روی تقسیم سلولی غیرمعمول : بررسی نقش تقسیمهای نامتقارن و پیامدهای آن در توسعه بافتها و بیماریها، که میتواند به درک بهتر بیماریهای ژنتیکی و سرطان کمک کند.
- همکاری میانرشتهای: تلفیق دانش زیستشناسی سلولی، بیوانفورماتیک، مهندسی زیستی و پزشکی برای یافتن راهکارهای نوین درمانی و تشخیصی.
از دیدگاه درمانی، هدفگیری دقیق تقسیم سلولی، به ویژه در سرطان، یکی از امیدبخشترین رویکردها است که با استفاده از داروهای نوین، ایمونوتراپی و فناوریهای ژندرمانی میتواند به بهبود چشمگیر نتایج بیماران منجر شود.
در نهایت، تاکید بر اهمیت تحقیقات پایهای و بالینی هماهنگ برای درک کاملتر و بهرهبرداری بهینه از دانش تقسیم سلولی، نقطه عطفی در پیشرفتهای پزشکی آینده خواهد بود. به این ترتیب، میتوانیم به سمت درمانهای کمعارضهتر، مؤثرتر و پایدارتر حرکت کنیم که نه تنها بیماریها را کنترل میکنند، بلکه کیفیت زندگی بیماران را نیز بهبود میبخشند.
تقسیم سلولی به عنوان محور اصلی زندگی سلولی، همچنان یکی از زمینههای پویای علوم زیستی و پزشکی است که با پیشرفتهای روزافزون در فناوری و دانش، فرصتهای بیسابقهای برای توسعه درمانهای نوین و بهبود سلامت انسان فراهم میآورد. آینده تحقیقات در این حوزه، نویدبخش کشفهای جدید و کاربردهای بالینی گستردهای است که میتوانند تحولات بنیادینی در علوم زیستی و پزشکی ایجاد کنند.
