میتوکندری و تولید انرژی
مقدمه
میتوکندری، اغلب با عنوان «نیروگاه سلول» شناخته میشود؛ زیرا این ارگانل حیاتی در تولید انرژی سلولی نقش محوری دارد. انرژیای که میتوکندری تولید میکند، اساس بسیاری از فعالیتهای بیولوژیکی و فیزیولوژیکی بدن است، از انقباض عضلات گرفته تا فرایندهای تنظیم متابولیکی و عملکردهای عصبی. بدون عملکرد صحیح میتوکندری، سلولها قادر به ادامه حیات و انجام وظایف خود نخواهند بود.
در چند دهه اخیر، دانشمندان پی بردهاند که میتوکندری بسیار فراتر از یک «نیروگاه» ساده است. این ساختار پیچیده، نقشهای متعددی در تنظیم مرگ برنامهریزی شده سلول (آپوپتوز)، تنظیم پاسخهای ایمنی، و حتی کنترل مسیرهای سیگنالینگ داخل سلولی ایفا میکند. همین امر باعث شده که میتوکندری به یکی از موضوعات محوری و کلیدی در حوزههای مختلف علوم زیستی و پزشکی تبدیل شود.
اهمیت میتوکندری در سلامت انسان به حدی است که اختلالات عملکردی آن با بیماریهای متعددی از جمله بیماریهای عصبی، بیماریهای قلبی-عروقی، دیابت، سرطان و فرایندهای پیری مرتبط شده است. به همین دلیل، شناخت دقیق ساختار و عملکرد میتوکندری، به عنوان پایهای برای درک بسیاری از بیماریها و توسعه روشهای درمانی نوین، ضروری است.
در این مقاله، تلاش شده است که یک مرور جامع و علمی ارائه شود که هم برای متخصصان این حوزه مفید باشد و هم مخاطبانی که به دنبال درک بهتر عملکردهای پیچیده میتوکندری هستند، بتوانند از آن بهره ببرند.
از بررسی ساختار پیچیده میتوکندری و مکانیسمهای تولید انرژی گرفته تا نقش کلیدی آن در آپوپتوز و بیماریها، این مقاله همه جنبههای مهم میتوکندری را پوشش خواهد داد.
هدف این مقاله، ارائه اطلاعات دقیق و بهروز است که بتواند به افزایش دانش علمی، ارتقای فهم پزشکی و جذب علاقهمندان به مباحث زیستشناسی سلولی و پزشکی کمک کند.
میتوکندری و تولید انرژی: نگاه کلی
در قلب هر سلول زنده، میتوکندری به عنوان مرکز اصلی تولید انرژی شناخته میشود. این ارگانل کوچک اما پیچیده، مسئول تامین انرژی لازم برای حفظ فعالیتهای حیاتی سلولی است. به عبارت سادهتر، میتوکندری نیروی محرکه سلولها را فراهم میآورد و به همین دلیل، عملکرد صحیح آن برای سلامت کل بدن حیاتی است.
انرژی سلولی عمدتاً به شکل مولکول آدنوزین تریفسفات (ATP) ذخیره و منتقل میشود. ATP همان منبع انرژی است که سلولها برای انجام فرآیندهای مختلف مانند سنتز پروتئین، انقباض عضلانی، انتقال یونها و حتی تقسیم سلولی به آن نیاز دارند. میتوکندری این مولکول ارزشمند را از طریق فرایندی به نام فسفوریلاسیون اکسیداتیو تولید میکند که در ادامه به طور مفصل بررسی خواهد شد.
یکی از نکات مهم درباره تولید انرژی در میتوکندری، کارایی بالای این فرآیند نسبت به سایر مسیرهای متابولیکی است. در مقایسه با گلیکولیز که در سیتوپلاسم سلول رخ میدهد و انرژی کمتری تولید میکند، میتوکندری با استفاده از سوختهایی مانند گلوکز، اسیدهای چرب و پروتئینها، انرژی را به صورت بسیار کارآمدتری استخراج میکند. این ویژگی باعث شده که میتوکندری به عنوان «نیروگاه اصلی» سلول شناخته شود.
اما میتوکندری تنها نقش تولید انرژی را ایفا نمیکند؛ این ارگانل به عنوان یک مرکز تنظیمکننده متابولیسم سلولی عمل میکند و در تنظیم مسیرهای مختلف بیوشیمیایی دخیل است. همچنین میتوکندری در تنظیم تعادل یونهای کلسیم، تولید گونههای فعال اکسیژن (ROS) و سیگنالینگ سلولی نقش دارد که همه این فعالیتها در حفظ سلامت و عملکرد سلول تاثیرگذار هستند.
در نهایت، باید به این نکته اشاره کرد که میتوکندریها دارای مجموعهای از آنزیمها و پروتئینهای تخصصی هستند که هر کدام در مرحله خاصی از تولید انرژی نقش ایفا میکنند. این آنزیمها به طور هماهنگ فعالیت میکنند تا انرژی سلولی به طور پیوسته و پایدار تامین شود.
ساختار میتوکندری
میتوکندری یکی از پیچیدهترین و منحصربهفردترین ارگانلهای سلولی است که از چندین بخش ساختاری تشکیل شده و هر کدام نقش مشخص و حیاتی در عملکرد آن ایفا میکنند. شناخت دقیق ساختار میتوکندری پایهای ضروری برای درک چگونگی تولید انرژی و سایر عملکردهای حیاتی این ارگانل است.
در ظاهر، میتوکندری شبیه به یک بیضی کوچک یا میلهای شکل است که اندازه آن بسته به نوع سلول و شرایط متابولیکی میتواند متفاوت باشد. این ارگانل دو غشاء متمایز دارد که هر کدام ویژگیها و عملکردهای خاص خود را دارا هستند.
غشاء خارجی میتوکندری سطح آن را احاطه کرده و نسبتاً نفوذپذیر است. این غشاء شامل پروتئینهایی به نام پُرینها (porins) است که اجازه عبور مولکولهای کوچک و یونها را به داخل میتوکندری میدهد. غشاء خارجی نقش محافظتی دارد و محیط درون میتوکندری را از سایر بخشهای سلول جدا میکند.
در مقابل، غشاء داخلی میتوکندری بسیار تخصصیتر است و به شدت نفوذناپذیر است. این غشاء سطح داخلی میتوکندری را به صورت چینخوردهای به نام کریستا افزایش میدهد. افزایش سطح غشاء داخلی، فضای بیشتری برای جایگیری پروتئینها و آنزیمهای مربوط به زنجیره انتقال الکترون و فسفوریلاسیون اکسیداتیو فراهم میکند.
درون غشاء داخلی فضای ماتریکس قرار دارد که شامل آنزیمهای متعدد، DNA میتوکندری، RNA، ریبوزومها و سایر مولکولهای لازم برای سنتز پروتئینهای میتوکندریایی است. وجود DNA مستقل در ماتریکس، امکان تولید برخی از پروتئینهای ضروری میتوکندری را به طور مستقل از هسته سلول فراهم میکند که این موضوع اهمیت ویژهای در عملکرد و بقا میتوکندری دارد.
کریستاها نه تنها سطح غشاء داخلی را افزایش میدهند، بلکه نقش کلیدی در سازماندهی پروتئینها و آنزیمهای شرکتکننده در فرآیند تولید ATP دارند. هر کدام از این چینها میتوانند به عنوان واحدهای جداگانهای عمل کنند که کارایی میتوکندری در تولید انرژی را به حداکثر میرسانند.
از طرف دیگر، میتوکندریها قابلیت تغییر شکل و اندازه دارند و از طریق فرآیندهای همجوشی (fusion) و جدا شدن (fission)، تعداد و کیفیت خود را در سلول تنظیم میکنند. این قابلیتها به میتوکندری اجازه میدهد که به سرعت به تغییرات محیطی و نیازهای سلولی پاسخ دهد.
در نهایت، ارتباط میتوکندری با سایر اجزای سلول از طریق شبکههای پیچیدهای از پروتئینها و کانالهای سیگنالینگ، نقش مهمی در تنظیم متابولیسم، پاسخ به استرس و حفظ هموستازی سلولی دارد.
زنجیره انتقال الکترون و تولید ATP
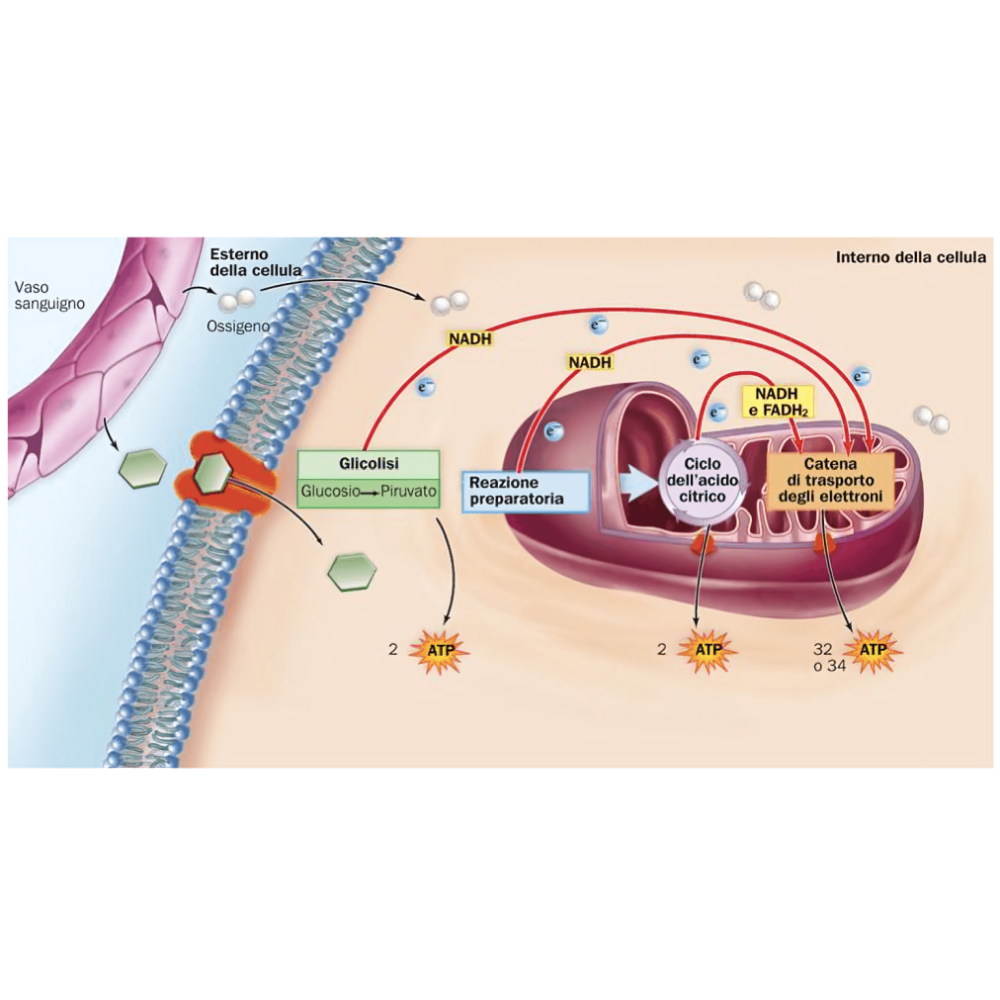
یکی از مهمترین عملکردهای میتوکندری، تولید انرژی به صورت مولکول ATP است که از طریق فرآیندی به نام فسفوریلاسیون اکسیداتیو انجام میشود. این فرآیند پیچیده در غشاء داخلی میتوکندری اتفاق میافتد و شامل چندین مرحله و مجموعهای از پروتئینها و آنزیمهاست که با هم همکاری میکنند تا انرژی آزاد شده از سوختهای مختلف را به شکل ATP ذخیره کنند.
در اینجا به تشریح مکانیسم زنجیره انتقال الکترون و نحوه تولید ATP میپردازیم:
در ابتدا، مولکولهای حامل الکترون مانند NADH و FADH2 که در مراحل قبلی متابولیسم (مثلاً چرخه کربس) ساخته شدهاند، الکترونهای خود را به زنجیره انتقال الکترون (Electron Transport Chain - ETC) میدهند. این زنجیره مجموعهای از چهار کمپلکس پروتئینی اصلی است که در غشاء داخلی میتوکندری مستقر هستند و شامل:
-
کمپلکس یک )NADH دِ هیدروژناز(
-
کمپلکس دو (سوکسینات دِ هیدروژناز(
-
کمپلکس سه (کوآنزیم Q – سیتوکروم c اکسیدوردوکتاز(
-
کمپلکس چهار (سیتوکروم c اکسیداز(
این کمپلکسها به ترتیب الکترونها را دریافت و از یک به دیگری منتقل میکنند و در این مسیر، انرژی آزاد شده را برای پمپ کردن پروتونها (H⁺) از ماتریکس به فضای بین دو غشاء میتوکندری استفاده میکنند. این پمپ پروتونها باعث ایجاد یک گرادیان الکتروشیمیایی یا پتانسیل پروتونی در طول غشاء داخلی میشود.
این گرادیان پروتونی همانند یک باتری شیمیایی عمل میکند که انرژی پتانسیل را ذخیره کرده است. در این مرحله، پروتونها از طریق آنزیم ATP سنتاز که در غشاء داخلی تعبیه شده است، به داخل ماتریکس بازمیگردند. جریان پروتونها از طریق این آنزیم انرژی لازم برای تبدیل آدنوزین دیفسفات (ADP) و فسفات غیرآلی (Pi) به آدنوزین تریفسفات (ATP) را فراهم میکند.
فرایند فسفوریلاسیون اکسیداتیو، بسیار کارآمد است و در مقایسه با گلیکولیز، تولید انرژی بسیار بیشتری دارد؛ به گونهای که از هر مولکول گلوکز تا حدود ۳۰ تا ۳۲ مولکول ATP تولید میشود که بیشتر آن ناشی از فعالیت زنجیره انتقال الکترون است.
همچنین باید اشاره کرد که در جریان انتقال الکترون، بخشی از الکترونها میتوانند به صورت ناقص به مولکولهای اکسیژن واکنش دهند و گونههای فعال اکسیژن (ROS) تولید کنند که در شرایط طبیعی نقش پیامرسانی دارند، اما در صورت افزایش بیش از حد میتوانند به سلول آسیب برسانند.
به همین دلیل، میتوکندری مجهز به سیستمهای آنتیاکسیدانی قوی است تا این رادیکالهای آزاد را کنترل کند و تعادل بین تولید انرژی و جلوگیری از آسیبهای اکسیداتیو را حفظ نماید.
در نهایت، عملکرد صحیح زنجیره انتقال الکترون و تولید ATP نه تنها برای تأمین انرژی سلولی ضروری است، بلکه بر سلامت عمومی سلول، تنظیم متابولیسم و پاسخ به شرایط استرسزا نیز تأثیر مستقیم دارد.
نقش میتوکندری در آپوپتوز (مرگ برنامهریزی شده سلول)
آپـوپتوز یا مرگ برنامهریزی شده سلول، فرآیندی حیاتی و پیچیده است که به حفظ سلامت بافتها و تنظیم تعداد سلولها در ارگانیزم کمک میکند. برخلاف مرگ سلولی غیرقابل کنترل مانند نکروز، آپوپتوز یک روند منظم و تنظیم شده است که سلول را به آرامی و بدون ایجاد التهاب از بین میبرد. میتوکندری به عنوان یک مرکز کلیدی در این فرآیند شناخته شده است و نقشهای حیاتی در آغاز و پیشبرد آپوپتوز ایفا میکند.
یکی از مهمترین نقشهای میتوکندری در آپوپتوز، کنترل انتشار مولکولهای سیگنالدهنده است. در شرایط استرس یا آسیب سلولی، غشاء خارجی میتوکندری نفوذپذیری خود را افزایش میدهد و مولکولهایی مانند سایتوکروم c را به فضای سیتوپلاسم آزاد میکند. انتشار سایتوکروم c به فضای سیتوپلاسم، نقطه آغازین فعالسازی مسیر آپوپتوز داخلی محسوب میشود.
در سیتوپلاسم، سایتوکروم c با پروتئینی به نام آپاف-1 (Apoptotic protease activating factor-1) ترکیب شده و کمپلکس اپوپتوزوم را تشکیل میدهد. این کمپلکس سپس پروکاسپاز-۹ را فعال میکند که در ادامه باعث فعال شدن کاسپازهای اجرایی مانند کاسپاز-۳ میشود. این کاسپازها مسئول تجزیه ساختارهای کلیدی سلولی و ایجاد ویژگیهای ظاهری آپوپتوز مانند انقباض سلول، خرد شدن DNA و تشکیل بادیهای آپوپتوتیک هستند.
یکی دیگر از اجزای کلیدی نقش میتوکندری در آپوپتوز، تنظیم تعادل بین پروتئینهای خانواده Bcl-2 است. این پروتئینها به دو گروه تقسیم میشوند: پروتئینهای ضدآپاپتوز (مانند Bcl-2 و (Bcl-xL و پروتئینهای پروآپاپتوز (مانند Bax و Bak). این خانواده پروتئینها بر روی غشاء خارجی میتوکندری عمل کرده و کنترل میکنند که آیا منافذ لازم برای انتشار مولکولهای آپوپتوزی مانند سایتوکروم c باز شود یا خیر.
همچنین میتوکندری در تولید گونههای فعال اکسیژن (ROS) نقش دارد که میتوانند به عنوان پیامرسانهای مولکولی در تحریک مسیرهای آپوپتوز عمل کنند. افزایش ROS موجب آسیب به DNA و سایر مولکولهای حیاتی شده و میتواند سلول را به سمت مرگ برنامهریزی شده هدایت کند.
از سوی دیگر، میتوکندریها در تنظیم انرژی سلولی در طول آپوپتوز نیز نقش دارند. کاهش تولید ATP ممکن است مسیرهای مرگ سلولی را تحت تأثیر قرار دهد، چرا که برخی مراحل آپوپتوز نیازمند انرژی هستند.
با توجه به این عملکردهای مهم، اختلال در عملکرد میتوکندری و مسیرهای آپوپتوز میتواند در بروز بیماریهای مختلف از جمله سرطان، بیماریهای نورودژنراتیو و اختلالات قلبی نقش داشته باشد. برای مثال، در بسیاری از سرطانها، سلولها با مهار آپوپتوز از طریق تغییر در عملکرد میتوکندری، از مرگ فرار میکنند و این امر به رشد و تهاجم تومور کمک میکند.
در نهایت، میتوان گفت که میتوکندری نه تنها یک کارخانه تولید انرژی است، بلکه نقش کلیدی در حفظ تعادل زندگی و مرگ سلولی دارد؛ تعادلی که سلامت و پایداری ارگانیزم را تضمین میکند.
میتوکندری و بیماریها
میتوکندری به عنوان مرکز اصلی تولید انرژی سلولی و تنظیمکننده فرآیندهای حیاتی، نقش محوری در حفظ سلامت سلول و ارگانیزم ایفا میکند. اختلالات عملکرد میتوکندری بهطور مستقیم با بروز و پیشرفت بسیاری از بیماریها ارتباط دارند. در این بخش، به بررسی مهمترین بیماریهای مرتبط با میتوکندری و مکانیزمهای دخیل پرداخته میشود.
بیماریهای میتوکندریایی ارثی یکی از گروههای اصلی بیماریهای مرتبط با نقص عملکرد میتوکندری هستند. این بیماریها معمولاً به علت جهشهای ژنتیکی در DNA میتوکندری یا ژنهای هستهای که پروتئینهای میتوکندریایی را کد میکنند، ایجاد میشوند. این اختلالات میتوانند منجر به نقص در زنجیره انتقال الکترون، کاهش تولید ATP و افزایش تولید گونههای فعال اکسیژن (ROS) شوند که نهایتاً موجب آسیب به بافتهای حساس مانند مغز، عضلات و قلب میگردد.
یکی از نمونههای بارز بیماریهای میتوکندریایی، میوپاتی میتوکندریایی است که با ضعف عضلانی و خستگی شدید مشخص میشود. همچنین سندرم لبر (Leber's Hereditary Optic Neuropathy)، بیماری دیگری است که به علت آسیب به میتوکندریها باعث از دست دادن بینایی میشود.
بیماریهای قلبی و عروقی نیز ارتباط نزدیکی با عملکرد میتوکندری دارند. قلب به دلیل نیاز بسیار بالا به انرژی، حساسیت زیادی نسبت به اختلالات میتوکندریایی دارد. اختلال در تولید انرژی میتواند منجر به مشکلاتی مانند نارسایی قلبی، آریتمی و بیماری عروق کرونر شود. همچنین تولید بیش از حد ROS در میتوکندریهای سلولهای قلبی باعث آسیب اکسیداتیو و التهاب میشود که روند بیماری را تشدید میکند.
در زمینه بیماریهای نورودژنراتیو، مانند بیماری آلزایمر، پارکینسون و هانتینگتون، نقش میتوکندری بهعنوان منبع اصلی انرژی و کنترلکننده آپوپتوز بسیار برجسته است. نقص در عملکرد میتوکندری منجر به کمبود انرژی در نورونها و افزایش استرس اکسیداتیو میشود که در نهایت باعث مرگ تدریجی سلولهای عصبی و بروز علائم بیماری میگردد.
سرطان یکی دیگر از حوزههایی است که میتوکندری نقش پیچیده و دوگانهای ایفا میکند. از یک سو، سلولهای سرطانی به انرژی زیادی نیاز دارند و میتوکندری نقش حیاتی در تامین این انرژی دارد؛ از سوی دیگر، تغییرات در مسیرهای متابولیکی میتوکندری به سلولهای سرطانی امکان میدهد تا از مرگ برنامهریزی شده فرار کنند و تکثیر بیرویه داشته باشند. بنابراین، میتوکندری هدفی مهم در توسعه درمانهای ضدسرطان محسوب میشود.
اختلالات متابولیکی مانند دیابت نوع دو نیز با عملکرد میتوکندری مرتبط هستند. کاهش کارایی میتوکندری در سلولهای بدن باعث مقاومت به انسولین و اختلال در متابولیسم گلوکز میشود که از علل اصلی دیابت به شمار میآید.
علاوه بر بیماریهای ذکر شده، میتوکندری در بیماریهای ریوی، کلیوی، کبدی و التهابی نیز نقش مهمی دارد. به عنوان مثال، در بیماریهای مزمن ریوی، اختلال در عملکرد میتوکندری باعث کاهش تولید انرژی و افزایش استرس اکسیداتیو میشود که به تخریب بافت ریوی منجر میگردد.
در نهایت، با توجه به اهمیت بیبدیل میتوکندری در سلامت سلولی، توجه به راهکارهای حفظ و بهبود عملکرد میتوکندری، از جمله تغذیه مناسب، ورزش منظم، کنترل استرس و توسعه داروهای هدفمند، میتواند نقش مهمی در پیشگیری و درمان بیماریها داشته باشد.
تنظیم و کنترل عملکرد میتوکندری
میتوکندری، بهعنوان نیروگاه سلول، باید عملکرد خود را بهصورت دقیق و پویا تنظیم کند تا بتواند نیازهای انرژی متغیر سلول را برآورده سازد و در عین حال از تولید آسیبهای ناشی از استرس اکسیداتیو جلوگیری نماید. تنظیم عملکرد میتوکندری به چندین مکانیسم پیچیده وابسته است که در ادامه به آنها پرداخته میشود.
تنظیم متابولیسم انرژی در میتوکندری به واسطهی کنترل فعالیت زنجیره انتقال الکترون و میزان تولید ATP انجام میگیرد. سلولها از طریق تغییر در میزان ورودی سوبستراها (مانند NADH و (FADH2 و تنظیم فعالیت آنزیمهای کلیدی میتوکندری، متابولیسم انرژی را کنترل میکنند. علاوه بر این، پروتئینهای uncoupling (از جمله UCP ها) نقش مهمی در کاهش تولید ATP و تولید گرما ایفا میکنند که در تنظیم تعادل انرژی و پاسخ به استرسهای محیطی حیاتی است.
پویایی میتوکندریایی، شامل فرآیندهای فیوژن (ادغام) و فیسیون (انشعاب) میباشد که به حفظ کیفیت و توزیع مناسب میتوکندریها در سلول کمک میکند. این فرآیندها به سلول امکان میدهند میتوکندریهای آسیبدیده را جدا کند یا میتوکندریهای سالم را ترکیب کرده و عملکرد بهینهای ایجاد کنند. پروتئینهای کلیدی مانند میتوفوسینها (Mfn1 و Mfn2) و دراماتین (Drp1) نقش اصلی در این فرآیندها دارند.
بقای میتوکندری از طریق فرآیندی به نام میتوفاژی (Mitophagy) کنترل میشود. میتوفاژی فرآیند انتخابی تخریب میتوکندریهای آسیبدیده یا ناکارآمد است که از تجمع مواد آسیبزا و اختلال در عملکرد سلولی جلوگیری میکند. این فرآیند توسط پروتئینهایی مانند PINK1 و Parkin تنظیم میشود و نقش مهمی در پیشگیری از بیماریهایی مانند پارکینسون ایفا میکند.
تنظیم ژنتیکی عملکرد میتوکندری نیز از اهمیت ویژهای برخوردار است. میتوکندری دارای DNA مخصوص به خود است که ژنهای کدکننده بخشی از پروتئینهای زنجیره انتقال الکترون و ربیوزومی را در خود دارد. علاوه بر این، بیان ژنهای هستهای مرتبط با میتوکندری به طور دقیق تنظیم میشود تا بتواند نیازهای متابولیکی سلول را تامین کند. مسیرهای سیگنالدهی هسته-میتوکندری در تنظیم این تعامل نقش دارند.
کنترل کیفیت پروتئینهای میتوکندری از طریق سامانههای پروتئولیتیک داخلی میتوکندری انجام میشود. این سامانهها از تجمع پروتئینهای معیوب جلوگیری کرده و عملکرد صحیح اندامک را تضمین میکنند. همچنین پاسخ سلولی به استرسهای محیطی مانند استرس اکسیداتیو موجب فعال شدن مسیرهای تنظیمی خاص برای حفظ تعادل و بازسازی میتوکندری میشود.
تأثیر مسیرهای سیگنالینگ سلولی بر عملکرد میتوکندری نیز بسیار مهم است. پیامرسانهای سلولی مانند AMP- activated protein kinase (AMPK) و mTOR، بسته به شرایط متابولیکی سلول، عملکرد میتوکندری را تعدیل میکنند. به عنوان مثال، AMPK در شرایط کمبود انرژی فعال شده و باعث افزایش بیوژنز میتوکندری و بهبود کارایی تولید ATP میشود.
در نهایت، ارتباط متقابل میتوکندری با دیگر اندامکهای سلولی، از جمله شبکه آندوپلاسمی و هسته، به تنظیم عملکرد کلی سلول کمک میکند. این ارتباط از طریق انتقال کلسیم، سیگنالهای متابولیکی و انتقال پروتئینها صورت میگیرد.
میتوکندری و سیستم ایمنی
میتوکندری نقش بسیار مهمی فراتر از تولید انرژی در سلولها ایفا میکند؛ یکی از این نقشها، تأثیرگذاری بر عملکرد سیستم ایمنی است. امروزه تحقیقات نشان دادهاند که میتوکندری، علاوه بر اینکه منبع اصلی تولید ATP محسوب میشود، در تنظیم پاسخهای ایمنی نیز نقشی کلیدی دارد.
یکی از مهمترین جنبههای ارتباط میتوکندری با سیستم ایمنی، نقش آن در تولید گونههای فعال اکسیژن (ROS) است. ROSهای تولید شده در میتوکندری به عنوان مولکولهای سیگنالدهنده عمل میکنند و میتوانند مسیرهای التهابی را فعال یا تعدیل کنند. اگرچه مقدار کنترل شدهی ROS برای پاسخ ایمنی مناسب ضروری است، تولید بیش از حد آن میتواند باعث آسیب به بافت و ایجاد بیماریهای التهابی مزمن شود.
میتوکندری همچنین در فعالسازی سیستم ایمنی ذاتی (Innate Immunity) نقش مهمی دارد. به عنوان مثال، DNA آزاد شده از میتوکندری (mtDNA) که هنگام آسیب یا استرس سلولی به بیرون از میتوکندری میریزد، میتواند به عنوان یک الگوی مولکولی مرتبط با خطر (DAMP) شناخته شود و سیستم ایمنی را تحریک کند. این مولکولها از طریق گیرندههای شناساگر الگو (PRRs) مانند NLRP3 inflammasome، مسیرهای التهابی را فعال میکنند و منجر به تولید سیتوکینهای التهابی میشوند.
علاوه بر این، میتوکندری در تنظیم فعالیت لنفوسیتها و سلولهای ایمنی تخصصی مانند ماکروفاژها، نوتروفیلها و سلولهای دندریتیک نقش دارد. تنظیم متابولیسم این سلولها توسط میتوکندری، برای عملکرد صحیح و پاسخدهی مناسب به عوامل عفونی ضروری است. به طور مثال، تغییر در میزان تولید ATP و نوع متابولیسم سلولی (بین متابولیسم هوازی و بیهوازی) میتواند به تغییر نوع پاسخ ایمنی کمک کند.
میتوکندری همچنین در فرآیند آپتوپتوز سلولهای ایمنی دخیل است که برای کنترل پاسخ ایمنی و جلوگیری از التهاب بیش از حد و بیماریهای خودایمنی اهمیت دارد. این فرآیند به کمک مسیرهای سیگنالدهی میتوکندریایی و آزادسازی پروتئینهایی مانند سیتوکروم c انجام میشود.
در نهایت، اختلال در عملکرد میتوکندری میتواند به ایجاد یا تشدید بیماریهای التهابی و خودایمنی منجر شود. بیماریهایی مانند لوپوس اریتماتوس، آرتریت روماتوئید و بیماریهای التهابی روده، نمونههایی از این ارتباط هستند که در آنها اختلال میتوکندریایی نقش مهمی در مسیرهای التهابی و پاسخ ایمنی بازی میکند.
میتوکندری و آینده پزشکی
میتوکندری به عنوان مرکز تولید انرژی سلولی و یکی از مهمترین ارگانلهای سلولی، در سالهای اخیر به محور توجه محققان پزشکی تبدیل شده است. درک عمیقتر از عملکرد و نقش میتوکندری در سلامت و بیماری، مسیرهای جدیدی را برای تشخیص، درمان و پیشگیری بیماریها گشوده است که نویدبخش تحولات بزرگ در پزشکی آینده است.
یکی از مهمترین زمینههای نوین در پزشکی، هدفگذاری دارویی مستقیم روی میتوکندری است. با توجه به نقش میتوکندری در تولید انرژی، تنظیم آپوپتوز و تنظیم پاسخهای التهابی، داروهایی طراحی میشوند که بتوانند عملکرد این ارگانل را بهبود بخشند یا اختلالات میتوکندریایی را اصلاح کنند. این رویکردها میتوانند در درمان بیماریهای عصبی مانند پارکینسون و آلزایمر، بیماریهای قلبی-عروقی، دیابت و حتی برخی سرطانها موثر باشند.
درمانهای ژنتیکی و سلولی نیز آینده روشنی برای اصلاح نقصهای میتوکندریایی ارائه میدهند. تکنولوژیهایی مانند CRISPR/Cas9 و ویرایش ژن، امکان اصلاح جهشهای ژنی مرتبط با اختلالات میتوکندریایی را فراهم کردهاند. همچنین، استفاده از سلولهای بنیادی و انتقال میتوکندری سالم به سلولهای بیمار، از راهکارهای نوظهور در درمان بیماریهای میتوکندریایی به شمار میرود.
از سوی دیگر، تشخیص زودهنگام اختلالات میتوکندریایی با استفاده از فناوریهای پیشرفته تصویربرداری و بیومارکرهای زیستی، میتواند روند درمان را موثرتر کرده و به پیشگیری از آسیبهای جدیتر کمک کند. به کمک این فناوریها، پزشکان قادر خواهند بود عملکرد میتوکندری را در بافتها و ارگانهای مختلف با دقت بالا بررسی کنند و درمانهای هدفمندتری ارائه دهند.
همچنین، تحقیقات بر روی نقش میتوکندری در فرایند پیری، راهکارهایی برای افزایش طول عمر و بهبود کیفیت زندگی ارائه داده است. با تنظیم متابولیسم میتوکندری و کاهش استرس اکسیداتیو، میتوان فرآیندهای تخریب سلولی را کند کرد و از بیماریهای مرتبط با سن جلوگیری نمود.
در نهایت، پیشرفت در فهم نقش میتوکندری در سیستم ایمنی و التهاب میتواند منجر به درمان بهتر بیماریهای خودایمنی و التهابی شود. با هدفگذاری دقیق مسیرهای سیگنالدهی میتوکندری، امکان تنظیم پاسخهای ایمنی فراهم شده و میتوان التهاب مزمن را کنترل کرد.
جمعبندی و چشمانداز
میتوکندری به عنوان یکی از حیاتیترین ارگانلهای سلولی، نقش بنیادینی در تامین انرژی، تنظیم متابولیسم، کنترل مرگ برنامهریزی شده سلول (آپوپتوز) و حتی تنظیم سیستم ایمنی ایفا میکند. در این مقاله، به طور جامع به ساختار پیچیده میتوکندری، عملکردهای بیوشیمیایی آن، به ویژه زنجیره انتقال الکترون و تولید ATP، و نقش کلیدی آن در سلامت و بیماری پرداخته شد.
نقش میتوکندری در تولید انرژی، قلب عملکرد سلولها و بافتها است و بدون عملکرد صحیح این ارگانل، سلولها توانایی حفظ بقا و فعالیتهای حیاتی خود را از دست میدهند. همچنین، میتوکندری نه تنها تولید کننده انرژی، بلکه یکی از عوامل اصلی در تنظیم آپوپتوز است که به حفظ تعادل سلولی و جلوگیری از بیماریهای مختلف کمک میکند.
از سوی دیگر، اختلالات عملکرد میتوکندری در بروز بیماریهای متعددی از جمله اختلالات عصبی، بیماریهای قلبی، دیابت، سرطان و اختلالات پیری نقش بسیار مهمی دارند که امروزه به یکی از زمینههای اصلی تحقیقات پزشکی تبدیل شده است.
در حوزه درمان، تمرکز بر میتوکندری به عنوان هدف دارویی و ژنتیکی نویدبخش راهکارهای درمانی جدید و اختصاصی است که میتواند بسیاری از بیماریهای مزمن و صعبالعلاج را بهتر مدیریت یا حتی درمان کند. همچنین، پیشرفت در فناوریهای تشخیصی میتواند امکان پایش دقیقتر سلامت میتوکندری را فراهم آورد.
با توجه به اهمیت روزافزون میتوکندری در تنظیم عملکرد سلولی و سلامت عمومی، مطالعات آینده باید به درک عمیقتر مکانیسمهای تنظیم میتوکندری، تعامل آن با سایر ارگانلها و نقش آن در بیماریها و پیری بپردازند. این دانش میتواند مسیر را برای توسعه درمانهای نوین و بهبود کیفیت زندگی بیماران هموار سازد.
در نهایت، میتوکندری به عنوان یک «مرکز فرماندهی» در سلول، نه تنها منبع انرژی بلکه کلیدی برای درک بهتر بیولوژی سلولی، بیماریها و آینده پزشکی است. افزایش آگاهی عمومی و تخصصی در این حوزه میتواند تحولات شگرفی در سلامت و درمان ایجاد کند.